高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
已知三种一元弱酸的相对强弱为:$\text{HX}\gt \text{HY}\gt \text{HZ}$,$\rm 25\;\rm ^\circ\rm C$时,在浓度均为$0.1\,\text{mol}/\text{L}$的$\text{NaX}$、$\text{NaY}$、$\text{NaZ}$的混合溶液中,通入$\text{HCl}$气体,随着$\text{pOH}$增大,溶液中的与$\text{HA}$与${{\text{A}}^{-}}\rm (\text{HA}$表示三种弱酸、${{\text{A}}^{-}}$代表三种酸根离子$\rm )$的分布系数变化如图所示,下列说法中正确的是$(\quad\ \ \ \ )$
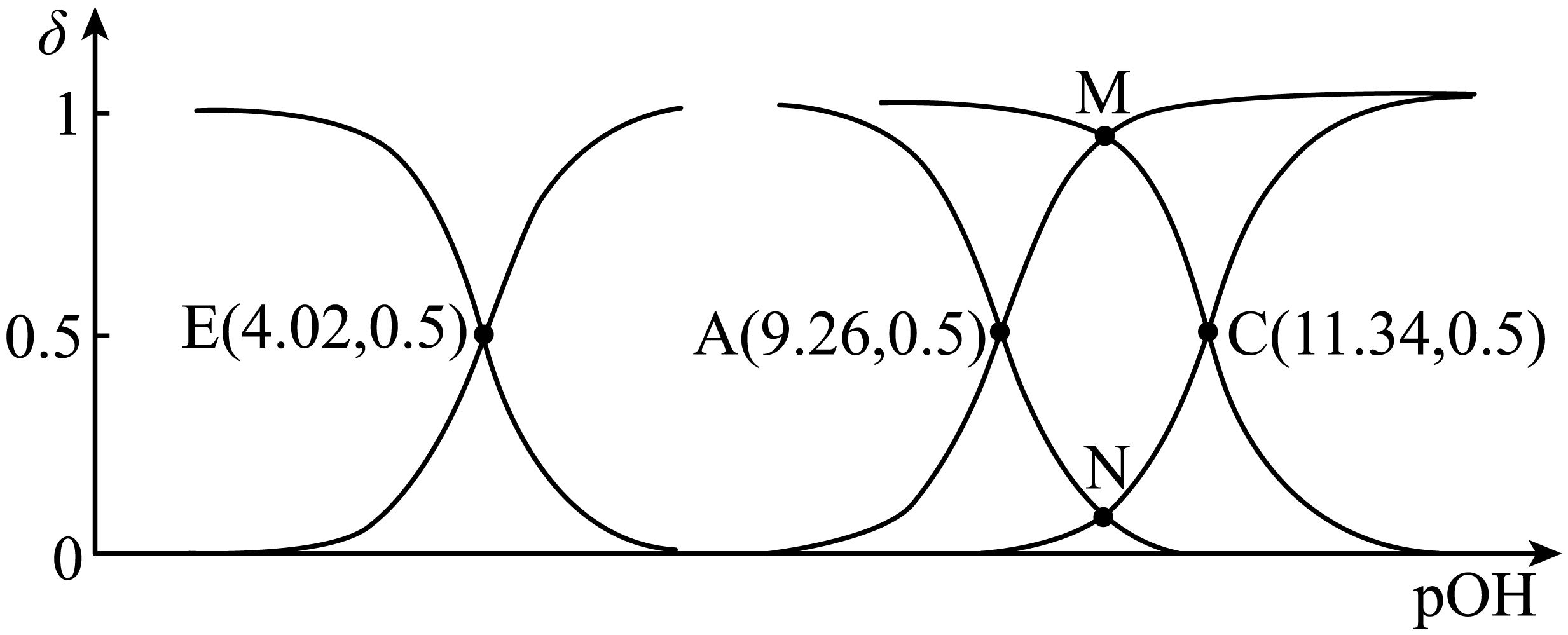
$\\rm 25\\;\\rm ^\\circ\\rm C$时,$\\text{HZ}$的电离常数${{K}_{\\text{Z}}}={{10}^{-11.34}}$
","$\\rm 25\\;\\rm ^\\circ\\rm C$时,反应${{\\text{X}}^{-}}+\\text{HY}\\rightleftharpoons \\text{HX}+{{\\text{Y}}^{-}}$的平衡常数$K={{10}^{-2.18}}$
","$\\text{pOH}=7$时溶液中:$c\\left( \\text{N}{{\\text{a}}^{+}} \\right)=c\\left( {{\\text{X}}^{-}} \\right)+c\\left( {{\\text{Y}}^{-}} \\right)+c\\left( {{\\text{Z}}^{-}} \\right)$
","交点$\\text{M}$、$\\text{N}$处的$\\text{pH}$相等且值为$\\rm 3.70$
"]$\rm A$.在$\text{25 }{}^\circ \text{C}$时,当$c(\text{HZ})=c({{\text{Z}}^{-}})$,即图中$\rm E$点,此时$\rm pOH$ $\rm =$ $\rm 4.02$,根据$\rm pH$ $\rm +$ $\rm pOH=14$,可得$\rm pH$ $\rm =$ $\rm 14$ $\rm -$ $\rm 4.02$ $\rm =$ $\rm 9.98$ ,而${{K}_{\text{Z}}}=\dfrac{c\text{(}{{\text{H}}^{+}}\text{)}\times c\text{(}{{\text{Z}}^{-}}\text{)}}{c\text{(HZ)}}$,当$c\text{(HZ)}=c\text{(}{{\text{Z}}^{-}}\text{)}$时,${{K}_{\text{Z}}}=c\text{(}{{\text{H}}^{+}}\text{)}=\text{1}{{\text{0}}^{\text{-9}\text{.98}}}$,不是$\text{1}{{\text{0}}^{\text{-11}\text{.34}}}$,所以选项$\rm A$错误;
$\rm B$.反应${{\text{X}}^{-}}\text{+HY}\rightleftharpoons \text{HX+}{{\text{Y}}^{-}}$的平衡常数$K=\dfrac{{{K}_{\text{a}}}\text{(HY)}}{{{K}_{\text{a}}}\text{(HX)}}$,由图可知,当$c\text{(HX)}=c\text{(}{{\text{X}}^{-}}\text{)}$时,即图中$\rm C$点处,$\rm pOH$ $\rm =$ $\rm 11.34$,$\rm pH$ $\rm =$ $\rm 14$ $\rm -$ $\rm 11.34$ $\rm =$ $\rm 2.66$,${{K}_{\text{a}}}\text{(HX)=1}{{\text{0}}^{\text{-2}\text{.66}}}$;当$c\text{(HY)}=c\text{(}{{\text{Y}}^{-}}\text{)}$时,即图中$\rm A$点处,$\rm pOH$ $\rm =$ $\rm 9.26$,$\rm pH$ $\rm =$ $\rm 14$ $\rm -$ $\rm 9.26$ $\rm =$ $\rm 4.74$,${{K}_{\text{a}}}\text{(HY)=1}{{\text{0}}^{\text{-4}\text{.74}}}$,则$K=\dfrac{\text{1}{{\text{0}}^{\text{-4}\text{.74}}}}{\text{1}{{\text{0}}^{\text{-2}\text{.66}}}}\text{=1}{{\text{0}}^{\text{-2}\text{.08}}}\ne \text{1}{{\text{0}}^{\text{-2}\text{.18}}}$,所以选项$\rm B$错误 ;
$\rm C$.通入$\rm HCl$气体后,溶液中的电荷守恒为$c(\text{N}{{\text{a}}^{+}})+c({{\text{H}}^{+}})=c({{\text{X}}^{-}})+c({{\text{Y}}^{-}})+c({{\text{Z}}^{-}})+c(\text{C}{{\text{l}}^{-}})+c(\text{O}{{\text{H}}^{-}})$。当$\rm pOH$ $\rm =$ $\rm 7$时,$c({{\text{H}}^{+}})=c(\text{O}{{\text{H}}^{-}})$,但溶液中存在$c\text{(C}{{\text{l}}^{-}}\text{)}$,所以$c(\text{N}{{\text{a}}^{+}})\gt c({{\text{X}}^{-}})+c({{\text{Y}}^{-}})+c({{\text{Z}}^{-}})$,选项$\rm C$错误;
$\rm D$.交点$\rm M$是$\rm X^{-}$与$\rm HY$分布系数相等的点,交点$\rm N$是$\rm HX$与$\rm Y^{-}$分布系数相等的点,$\rm HX$的$\text{p}{{K}_{\text{a}}}\text{=2}\text{.66}$,$\rm HY$的$\text{p}{{K}_{\text{a}}}\text{=4}\text{.74}$,根据电离平衡常数表达式可知$\text{pH}=\dfrac{\text{p}{{K}_{\text{a1}}}+\text{p}{{K}_{\text{a2}}}}{2}$,可得$\text{pH=}\dfrac{\text{2}\text{.66+4}\text{.74}}{\text{2}}\text{=3}\text{.70}$,所以交点$\rm M$、$\rm N$处的$\rm pH$相等且值为$\rm 3.70$ ,选项$\rm D$正确;
故选:$\rm D$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
