高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
利用平衡移动原理,分析一定温度下$\rm Mg^{2+}$在不同$\rm pH$的$\rm Na_{2}CO_{3}($起始浓度为$\rm 0.1\;\rm mol/L)$体系中的可能产物。
已知:ⅰ.下图$\rm 1$中曲线表示$\rm Na_{2}CO_{3}$体系中各含碳粒子的物质的量分数与$\rm pH$的关系。
ⅱ.下图$\rm 2$表示不同$\rm pH$下$c\rm (Mg^{2+})$的变化。
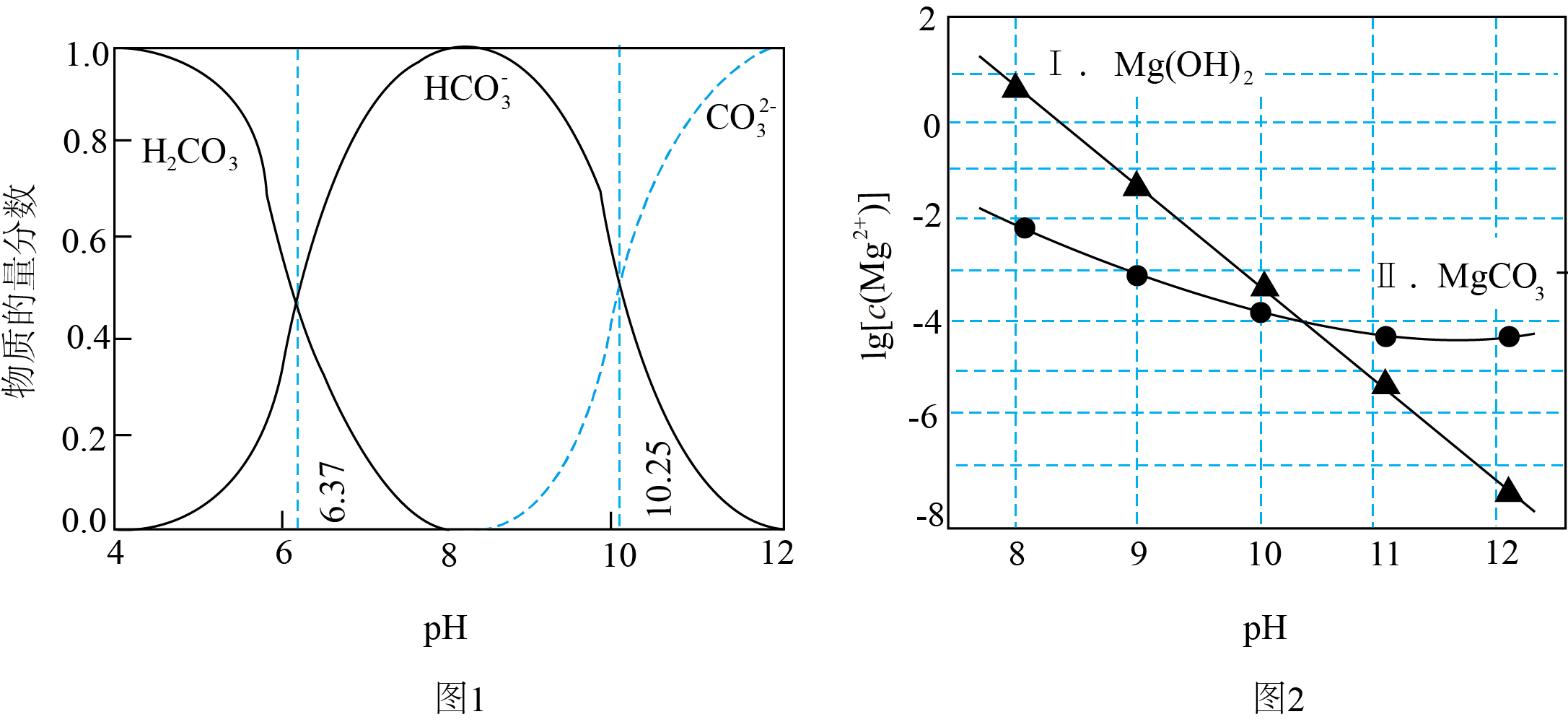
下列说法错误的是$(\qquad)$
由图$\\rm 1$,$\\dfrac{\\textit{c}\\left( \\text{CO}_{3}^{2-}\\right)\\cdot\\textit{c}^{2}\\left( \\text{H}^{+}\\right)}{\\textit{c}\\left( \\text{H}_{2}\\text{C}\\text{O}_{3}\\right)}=10^{-16.62}$
","在$\\rm pH=10.25$时,一定存在$\\textit{c}\\left( {{\\text{H}}_{2}}\\text{C}{{\\text{O}}_{3}} \\right)+2\\textit{c}\\left( \\text{CO}_{3}^{2-} \\right)=0.1\\;\\rm \\text{mol}\\cdot {{\\text{L}}^{-1}}$
","由图$\\rm 2$,初始状态$\\rm pH=11$、$\\text{lg}\\left[ \\textit{c}\\left( \\text{M}\\text{g}^{2+}\\right)\\right]=-6$,无沉淀生成
","由图$\\rm 1$和图$\\rm 2$,初始状态$\\text{pH}=8\\text{lg}\\left[ \\textit{c}\\left( \\text{M}\\text{g}^{2+}\\right)\\right]=-1$,主要生成$\\text{MgC}{{\\text{O}}_{3}}$沉淀
"]$\rm A$.由图$\rm 1$可知,当$c\rm (H_{2}CO_{3})=$ $ c(\text{HCO}_{\text{3}}^{-}\rm )$时溶液的$\rm pH=6.37$,故$ K_\rm {a1}(H_{2}CO_{3})=\dfrac{\textit{c}\rm {(HCO}_{\text{3}}^{-})\textit{c}({{\text{H}}^{+}}\text{)}}{\textit{c}({{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}\text{)}}\rm =10^{-6.37}$,同理当$c(\text{CO}_{\text{3}}^{\text{2-}}\rm )=\textit{c}(\text{HCO}_{\text{3}}^{-}\rm )$时,溶液的$\rm pH=10.25$,则$K_\rm {a2}(H_{2}CO_{3})=\dfrac{\textit{c}\rm {(CO}_{\text{3}}^{\text{2-}})\textit{c}({{\text{H}}^{+}}\text{)}}{\textit{c}\rm {(HCO}_{3}^{-}\text{)}}\rm =10^{-10.25}$,故$\dfrac{\textit{c}\rm {(CO}_{\text{3}}^{\text{2-}})\textit{c}({{\text{H}}^{+}}\text{)}}{\textit{c}\rm {(HCO}_{3}^{-}\text{)}}\rm =10^{-10.25}=\textit{K}_{\text{a}1}\textit{K}_{\text{a}2}=10^{-16.62}$,$\rm A$正确;
$\rm B$.根据物料守恒可知,在$\rm 0.1\;\rm mol/L\ Na_{2}CO_{3}$溶液中有:$c\rm (H_{2}CO_{3})+\textit{c}(\text{CO}_{\text{3}}^{\text{2-}}\rm )+\textit{c}(\text{HCO}_{\text{3}}^{-}\rm )=0.1\;\rm mol/L$,由图$\rm 1$可知,$\rm pH=10.25$时,$c(\text{CO}_{\text{3}}^{\text{2-}}\rm )=\textit{c}(\text{HCO}_{\text{3}}^{-}\rm )$,但由图$\rm 2$可知,在不同$\rm pH$和$ c\rm (Mg^{2+})$下,可能会析出$\rm MgCO_{3}$沉淀,故在$\rm pH=10.25$时,不一定存在$\textit{c}\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)+2\textit{c}\left( \text{CO}_{3}^{2-} \right)=0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,$\rm B$错误;
$\rm C$.由图$\rm 2$,初始状态$\rm pH=11$、$\rm \lg[\textit{c}(Mg^{2+})]=-6$的点位于曲线Ⅰ和曲线Ⅱ的下方,不会产生碳酸镁沉淀或氢氧化镁沉淀,$\rm C$正确;
$\rm D$.由图$\rm 1$可知,$\rm pH=8$时溶液中主要存$\text{HCO}_{\text{3}}^{-}$,由图$\rm 2$可知,$\rm \lg[\textit{c}(Mg^{2+})]=-1$时该点位于曲线Ⅱ的上方,曲线Ⅰ的下方,故有$\rm MgCO_{3}$沉淀生成没有$\rm Mg(OH)_{2}$沉淀生成,$\rm D$正确;
故选:$\rm B$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
