高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
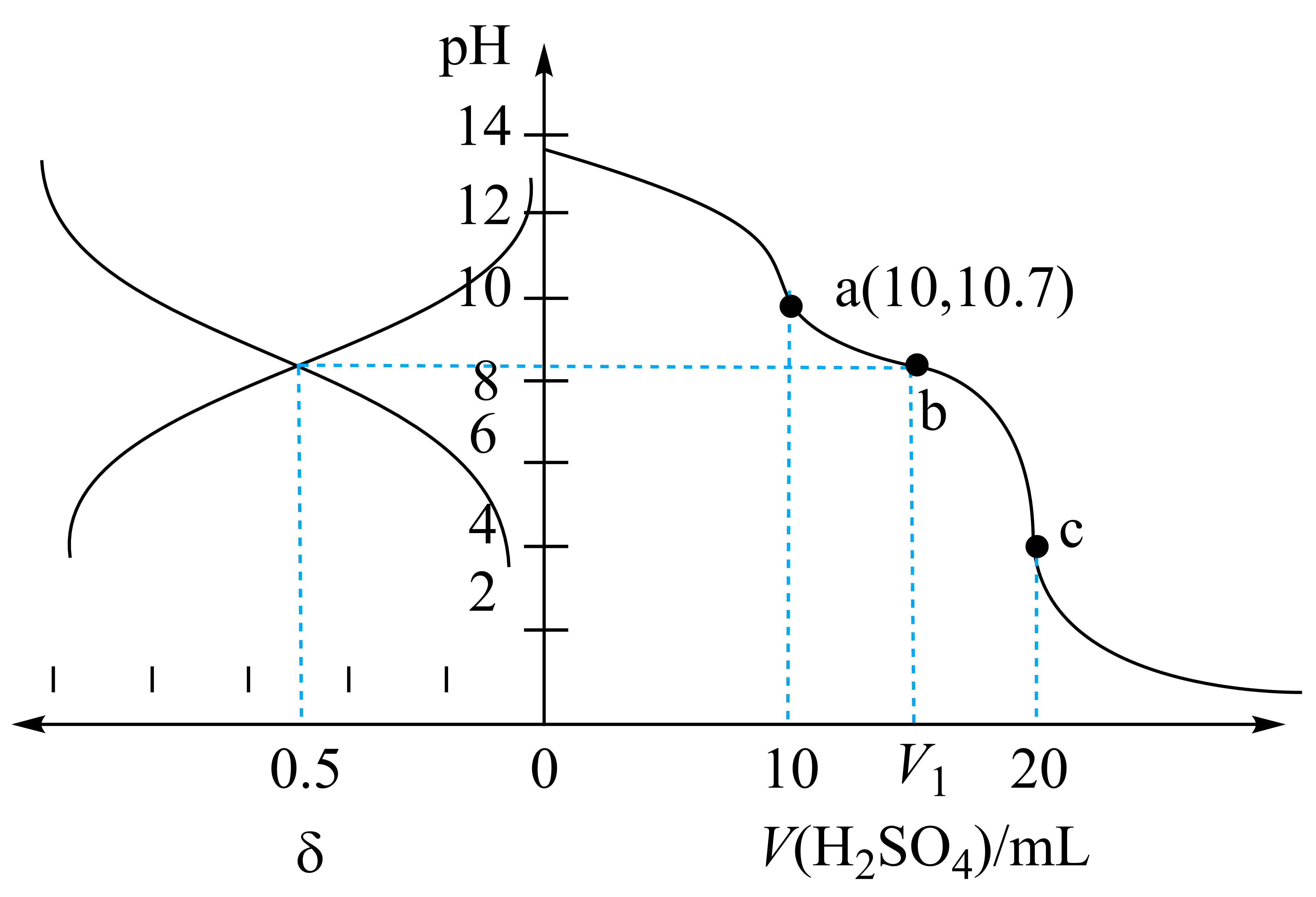
常温下,用浓度为$\rm 0.10\ {mol} \cdot {L}^{-1}$的$\rm {{H}_{2}}S{{O}_{4}}$标准溶液滴定$\rm 10\ mL$浓度均为$\rm 0.20\ mol\cdot {{L}^{-1}}$的$\rm NaOH$和$\rm {Na}_{2} {A}$的混合溶液,溶液中含$\rm A$微粒的分布分数$\rm \delta$随$\rm pH$变化曲线及滴定曲线如图$\rm ($忽略溶液混合后体积变化$\rm )$。下列说法错误的是$\rm (\qquad)$
$\\rm H{{A}^{-}}\\rightleftharpoons {{H}^{+}}+{{A}^{2-}}$的$K\\approx {{10}^{-8.4}}$
","点$\\rm a$:$c{\\rm (SO_{4}^{2-})}\\lt c{\\rm ({{A}^{2-}})}$
","${{V}_{1}}\\lt 15\\rm \\ mL$
","点$\\rm c$:$c{\\rm ({{H}^{+}})}+c{\\rm (N{{a}^{+}})}=4c{\\rm (SO_{4}^{2-})}+c{\\rm (O{{H}^{-}})}$
"]图中左侧溶液中含$\rm A$微粒的分布曲线只有两条,说明$\rm {{H}_{2}}A$第一步完全电离,溶液中含$\rm A$微粒有$\rm H{{A}^{-}}$、$\rm {{A}^{2-}}$,随着$\rm pH$值增大,溶液中$\rm {{A}^{2-}}$逐渐增多,$\rm H{{A}^{-}}$逐渐减小;图中右侧为$\rm pH$变化曲线。
$\rm A$.加入$\rm 10\ mL\ {{H}_{2}}S{{O}_{4}}$标准溶液时,$\rm NaOH$恰好完全反应,所得溶液为$\rm Na_{2}SO_{4}$和$\rm {Na}_{2} {A}$的混合溶液,溶液体积为$\rm 20\ mL$,$\rm pH=10.7$,溶液中$\rm OH^{-}$浓度为$\rm 10^{-3.3}\ mol/L$,根据$\rm \begin{matrix} {} & \rm {{A}^{2-}} & + & \rm {{H}_{2}}O & \rightleftharpoons & \rm H{{A}^{-}} & + & \rm O{{H}^{-}} \\ 起始\rm mol/L & 0.1 & {} & {} & {} & {} & {} & {} \\ 平衡\rm mol/L & \approx 0.1 & {} & {} & {} & {{10}^{-3.3}} & {} & {{10}^{-3.3}} \\ \end{matrix}$,求得${{K}_{\rm h}}\approx \dfrac{{{10}^{-3.3}}\times {{10}^{-3.3}}}{0.1}={{10}^{-5.6}}$,$\rm H{{A}^{-}}\rightleftharpoons {{H}^{+}}+{{A}^{2-}}$的$K=\dfrac{{{K}_{\rm w}}}{{{K}_{\rm h}}}\approx {{10}^{-8.4}}$,$\rm A$正确。
$\rm B$.点$\rm a$加入$\rm 10\ mL\ {{H}_{2}}S{{O}_{4}}$标准溶液,所得溶液为$\rm Na_{2}SO_{4}$和$\rm {Na}_{2} {A}$的混合溶液,溶液体积为$\rm 20\ mL$,$\rm Na_{2}SO_{4}$浓度为$\rm 0.05\ mol/L$,$\rm {Na}_{2} {A}$浓度为$\rm 0.1\ mol/L$,$\rm {{A}^{2-}}$水解程度较小,故$c{\rm (SO_{4}^{2-})}\lt c{\rm ({{A}^{2-}})}$,$\rm B$正确。
$\rm C$.若$V=15\rm \ mL$,混合后所得溶液中$\rm NaHA$和$\rm {Na}_{2} {A}$的浓度相同,由选项$\rm A$分析知,$\rm {{A}^{2-}}$水解程度大于$\rm H{{A}^{-}}$的电离程度,使得溶液中$\rm H{{A}^{-}}$浓度大于$\rm {{A}^{2-}}$,而$\rm b$点时$\rm H{{A}^{-}}$浓度等于$\rm {{A}^{2-}}$,可知$\rm b$点加入$\rm {{H}_{2}}S{{O}_{4}}$标准溶液小于$\rm 15\ mL$,${{V}_{1}}\lt 15\rm \ mL$,$\rm C$正确。
$\rm D$.点$\rm c$加入$\rm 20\ mL\ {{H}_{2}}S{{O}_{4}}$标准溶液,溶液中存在电荷守恒:$c{\rm ({{H}^{+}})}+c{\rm (N{{a}^{+}})}=2c{\rm (SO_{4}^{2-})}+c{\rm (O{{H}^{-}})}+c{\rm (H{{A}^{-}})}+2c{\rm ({{A}^{2-}})}$,存在物料守恒:$c{\rm (SO_{4}^{2-})}=c{\rm (H{{A}^{-}})}+c{\rm ({{A}^{2-}})}$,两式联立可得:$c{\rm ({{H}^{+}})}+c{\rm (N{{a}^{+}})}+c{\rm (H{{A}^{-}})}=4c{\rm (SO_{4}^{2-})}+c{\rm (O{{H}^{-}})}$,$\rm D$错误。
故选:$\rm D$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
