高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
氮氧化物可以引发多种污染问题,用氢气转化氮氧化物有产物无污染、转化成本低的优点而日益受到重视。回答下列问题:
已知有关化学键的键能数据如下表:
| 化学键 | $\rm H-H$ | $\rm N≡O$ | $\rm N≡N$ | $\rm H-O$ |
| 键能$\rm /(\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\rm )$ | $\rm 436$ | $\rm 632$ | $x$ | $\rm 464$ |
①氢气转化$\rm NO$的热化学方程式为$2{{\text{H}}_{2}}\left( \text{g} \right)+2\text{NO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad\Delta H=-666\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,该反应在 $\rm ($填“高温”或“低温”$\rm )$条件下更有利于自发进行;表格中$ x=$ 。
②将等物质的量的$\rm NO$、${{\text{H}}_{2}}$充入恒容密闭容器中,恒温条件下发生反应$2{{\text{H}}_{2}}\left( \text{g} \right)+2\text{NO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$。下列描述能说明该反应达到平衡状态的是 $\rm ($填标号$\rm )$。
$\rm A$.容器内$\rm {{\text{N}}_{2}}$的分压不再改变
$\rm B$.$n\left( {{\text{H}}_{2}} \right):n\left( \text{NO} \right):n\left( {{\text{N}}_{2}} \right):n\left( {{\text{H}}_{2}}\text{O} \right)=2:2:1:2$
$\rm C$.容器内混合气体的密度不再变化
$\rm D$.容器内体系的混乱度不再变化
低温;$\\rm 946$;$\\rm AD$
"]]①$2{{\text{H}}_{2}}\left( \text{g} \right)+2\text{NO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$正反应气体物质的量减少,$\Delta { S\lt 0}$,$\Delta H=-666\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,所以该反应在低温条件下更有利于自发进行;焓变$\rm =$反应物总键能$\rm -$生成物总键能,$436\times 2+632\times 2-x-464\times 4=-666$,$x=946$;
②$\rm A$.容器内$\rm {{\text{N}}_{2}}$的分压不再改变,说明$\rm {{\text{N}}_{2}}$的浓度不变,反应一定达到平衡状态,$\rm A$项符合题意;
$\rm B$.$n\left( {{\text{H}}_{2}} \right):n\left( \text{NO} \right):n\left( {{\text{N}}_{2}} \right):n\left( {{\text{H}}_{2}}\text{O} \right)=2:2:1:2$,不能判断浓度是否发生改变,反应不一定平衡,$\rm B$项不符合题意;
$\rm C$.反应前后气体总质量不变、容器体积不变,密度是恒量,容器内混合气体的密度不再变化,反应不一定达到平衡状态,$\rm C$项不符合题意;
$\rm D$.反应前后气体物质的量不同,容器内体系的混乱度不再变化,说明气体物质的量不再改变,反应一定达到平衡状态,$\rm D$项符合题意;
目前氢气还原氮氧化物通常用金属铑$\rm (Rh)$作催化剂,已知金属铑属于立方晶系,其晶胞中铑原子位于顶点及每个面的中心,晶胞参数为$y\;\rm pm$。则铑原子的配位数为 ;金属铑晶体的密度为 $\text{g}\cdot \text{c}{{\text{m}}^{-3}}\rm ($阿伏加德罗常数的值为${{N}_{\text{A}}}\rm )$。
$\\rm 12$;$\\dfrac{412}{{{y}^{3}}\\cdot {{N}_{\\text{A}}}}\\times {{10}^{30}}$
"]]已知金属铑属于立方晶系,铑原子位于顶点及每个面的中心,则铑原子的配位数为$\rm 12$;根据均摊原则,晶胞中$\rm Rh$的个数为$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$,金属铑晶体的密度为。$\dfrac{4\times 103}{{{\left( y\times {{10}^{-10}} \right)}^{3}}\times {{N}_{\text{A}}}}=\dfrac{412}{{{y}^{3}}\cdot {{N}_{\text{A}}}}\times {{10}^{30}}\text{ g}\cdot \text{c}{{\text{m}}^{-3}}$;
研究表明,反应$2{{\text{H}}_{2}}\left( \text{g} \right)+2\text{NO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$按如下机理进行$\rm (a$、$b$、$c$均为正数$\rm )$:
①$2\text{NO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta H=-a\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$ 快平衡
②${{\text{N}}_{2}}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta H=+b\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$ 慢平衡
③${{\text{H}}_{2}}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons 2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad\Delta H=-c\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$ 快平衡
上述反应机理中,速率控制步骤为 $\rm ($填步骤前的标号$\rm )$,$\left( a+c \right)$ $ b($填“$\rm \gt $”“$\rm =$”或“$\rm \lt $”$\rm )$。
②;$\\rm \\gt $
"]]慢反应决定总反应速率,上述反应机理中,速率控制步骤为②;根据盖斯定律①$\rm +$②$\rm +$③得$2{{\text{H}}_{2}}\left( \text{g} \right)+2\text{NO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad\Delta H=\left( b-a-c \right)\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}\lt 0$,$\left( a+c \right)\gt b$;
向体积为$\rm 2\;\rm L$的恒温密闭容器中充入$\rm 2\;\rm mol$ ${{\text{H}}_{2}}$和$\rm 2\;\rm mol$ $\rm NO$,起始压强为$ p\;\rm kPa$,发生反应$2{{\text{H}}_{2}}\left( \text{g} \right)+2\text{NO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$。容器中${{\text{H}}_{2}}\text{O}$的物质的量随时间的变化关系如图所示。
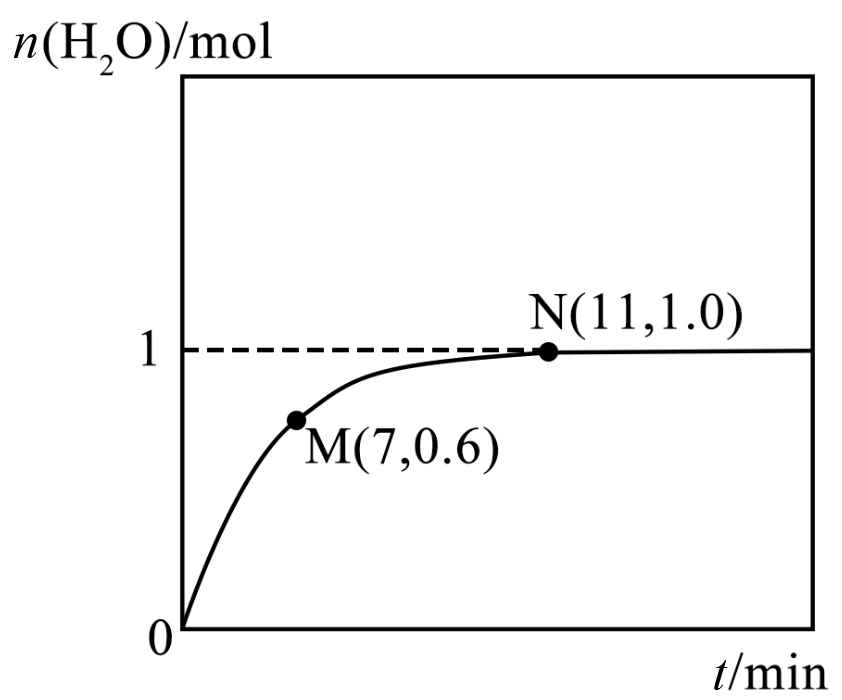
该反应的${{K}_{\text{p}}}=$ $\text{kP}{{\text{a}}^{-1}}\rm ($化为最简式$\rm )$。
$\\dfrac{2}{p}$
"]]根据图像,反应达到平衡状态生成$\rm 1\;\rm mol$ ${{\text{H}}_{2}}\text{O}$,则同时生成$\rm 0.5\;\rm mo$ ${{\text{N}}_{2}}$、消耗$\rm 1\;\rm mol$ ${{\text{H}}_{2}}$、消耗$\rm 1\;\rm mol$ $\rm NO$,平衡时$\rm NO$、${{\text{H}}_{2}}$、${{\text{N}}_{2}}$、${{\text{H}}_{2}}\text{O}$的物质的量分别为$\rm 1\;\rm mol$、$\rm 1\;\rm mol$、$\rm 0.5\;\rm mol$、$\rm 1\;\rm mol$,压强比等于物质的量之比,平衡时气体总压强为$\dfrac{7p}{8}\;\rm kPa$,该反应的${{K}_{\text{p}}}=\dfrac{{{\left( \dfrac{1}{3.5}\times \dfrac{7p}{8}\text{ kPa} \right)}^{2}}\times \left( \dfrac{0.5}{3.5}\times \dfrac{7p}{8}\text{ kPa} \right)}{{{\left( \dfrac{1}{3.5}\times \dfrac{7p}{8}\text{ kPa} \right)}^{2}}\times {{\left( \dfrac{1}{3.5}\times \dfrac{7p}{8}\text{ kPa} \right)}^{2}}}=\dfrac{2}{p}\text{ kP}{{\text{a}}^{-1}}$。
高中 | 化学平衡常数题目答案及解析(完整版)
