高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
柠檬酸是常见的多元酸,其分子结构为 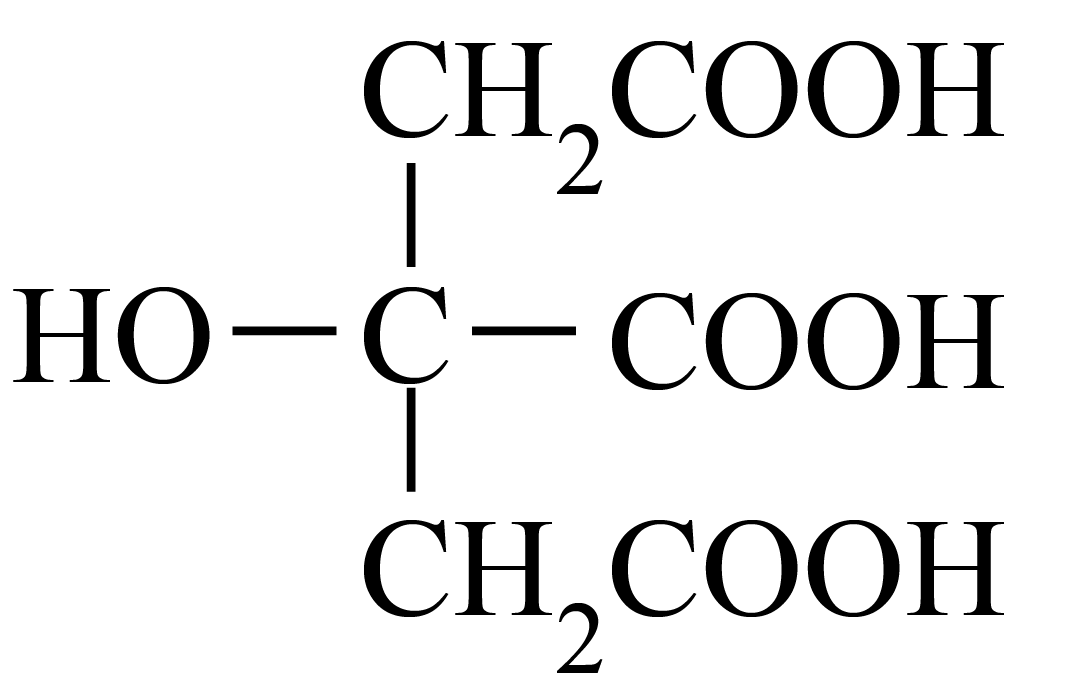 $\rm ($用$\rm {{{H}}_{{3}}}{R}$表示$\rm )$。常温下,用$\rm {0}{.1000\;\rm mol}\cdot {{{L}}^{{-1}}}\;{NaOH}$溶液滴定$\rm {20}{.00\;\rm mL\;\rm 0}{.1000\;\rm mol}\cdot {{{L}}^{{-1}}}\;{{{H}}_{{3}}}{R}$溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为:${{{K}}_{\rm {a1}}}{=1}{.0}\times {1}{{{0}}^{{-3}{.1}}}$,${{{K}}_{\rm {a2}}}{=1}{.0}\times {1}{{{0}}^{{-4}{.8}}}$,${{{K}}_{\rm {a3}}}{=1}{.0}\times {1}{{{0}}^{{-6}{.4}}}$。下列叙述正确的是$(\qquad)$
$\rm ($用$\rm {{{H}}_{{3}}}{R}$表示$\rm )$。常温下,用$\rm {0}{.1000\;\rm mol}\cdot {{{L}}^{{-1}}}\;{NaOH}$溶液滴定$\rm {20}{.00\;\rm mL\;\rm 0}{.1000\;\rm mol}\cdot {{{L}}^{{-1}}}\;{{{H}}_{{3}}}{R}$溶液的滴定曲线如图所示。已知常温下柠檬酸的电离常数为:${{{K}}_{\rm {a1}}}{=1}{.0}\times {1}{{{0}}^{{-3}{.1}}}$,${{{K}}_{\rm {a2}}}{=1}{.0}\times {1}{{{0}}^{{-4}{.8}}}$,${{{K}}_{\rm {a3}}}{=1}{.0}\times {1}{{{0}}^{{-6}{.4}}}$。下列叙述正确的是$(\qquad)$
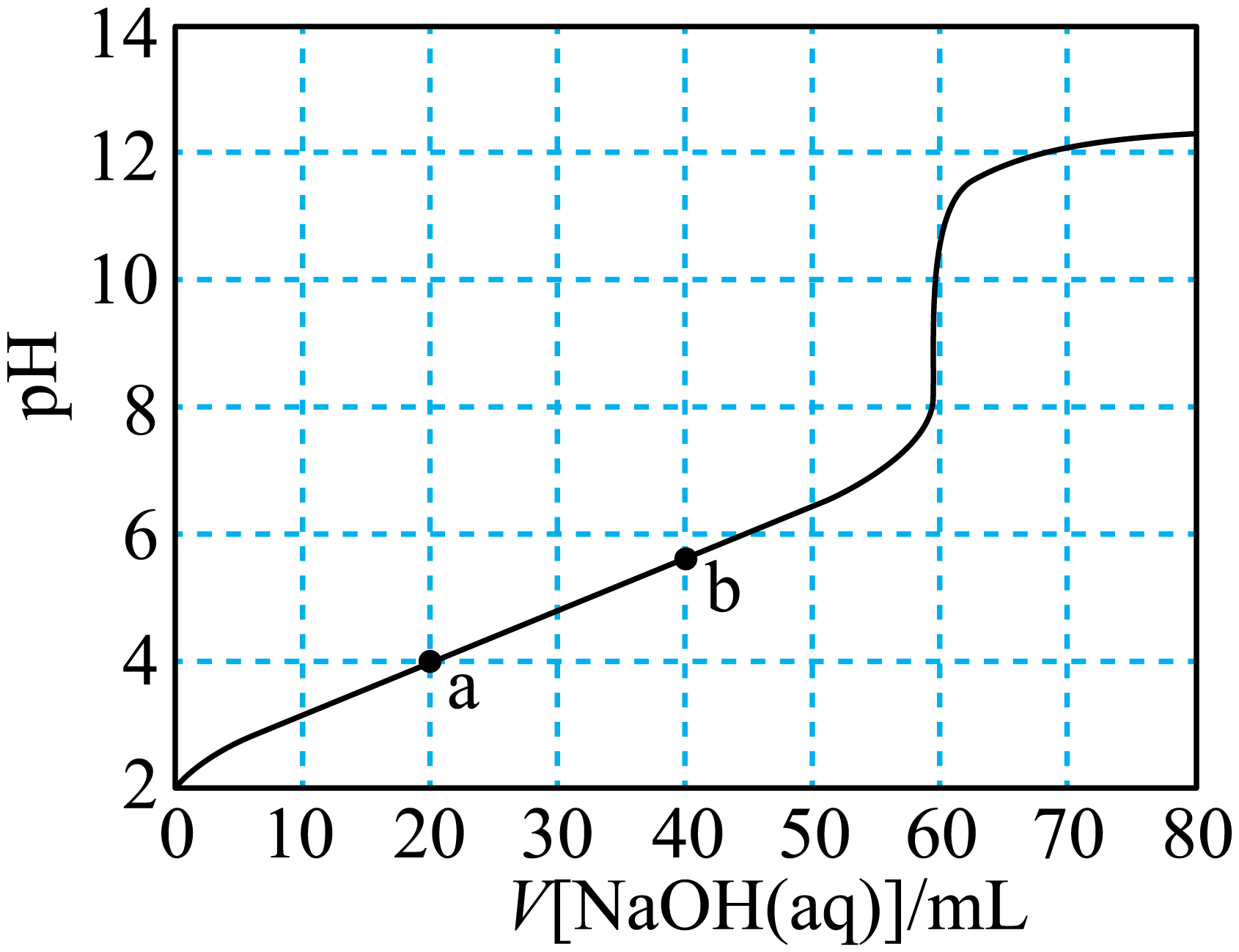
$\\rm a$点溶液中,${c}\\left( \\text{N}{{\\text{a}}^{+}} \\right)=c\\left( {{\\text{H}}_{\\text{2}}}{{\\text{R}}^{-}} \\right)+2c\\left( \\text{H}{{\\text{R}}^{{2-}}} \\right)+3c\\left( {{\\text{R}}^{\\text{3-}}} \\right)$
","$\\rm b$点溶液中,${c}\\left( \\text{N}{{\\text{a}}^{+}} \\right)\\gt {c}\\left( \\text{H}{{\\text{R}}^{{2-}}} \\right)\\gt {c}\\left( {{\\text{H}}_{\\text{2}}}{{\\text{R}}^{-}} \\right)\\gt {c}\\left( {{\\text{R}}^{ {3-}}} \\right)$
","常温下${{\\text{R}}^{ {3-}}}$的水解常数为$\\text{1}\\text{.0}\\times \\text{1}{{\\text{0}}^{ {-10}\\text{.9}}}$
","常温下$\\text{N}{{\\text{a}}_{\\text{2}}}\\text{HR}$溶液加水稀释过程中,$\\dfrac{{c}\\left( {{\\text{H}}_{\\text{2}}}{{\\text{R}}^{-}} \\right)}{{c}\\left( \\text{H}{{\\text{R}}^{{2-}}} \\right)}$减小
"]图像为向柠檬酸中逐渐滴加氢氧化钠的$\rm pH$变化图像,$\rm a$点时加入氢氧化钠$\rm 20\;\rm mL$,$\rm {{\text{H}}_{\text{3}}}\text{R}$与氢氧化钠物质的量为$\rm 1: 1$,所以$\rm a$点产物为$\rm \text{Na}{{\text{H}}_{2}}\text{R}$,$\rm b$点时$\rm {{\text{H}}_{\text{3}}}\text{R}$与氢氧化钠物质的量为$\rm 1: 2$,所以$\rm b$点主要为$\rm \text{N}{{\text{a}}_{\text{2}}}\text{HR}$,再结合盐类水解和弱电解质电离规律进行作答。
$\rm A$.$\rm a$点溶液成分为$\text{Na}{{\text{H}}_{\text{2}}}\text{R}$,由电荷守恒可知${c}\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)=c\text{(OH)}+c \left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)+2c\left( \text{H}{{\text{R}}^{{2-}}} \right)+3c\left( {{\text{R}}^{\text{3-}}} \right)$,$a$点溶液呈酸性,${c}\left( {{\text{H}}^{+}} \right)\gt {c}\left( \text{O}{{\text{H}}^{-}} \right)$,${c}\left( \text{N}{{\text{a}}^{+}} \right)\lt {c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)+2c\left( \text{H}{{\text{R}}^{{2-}}} \right)+3c\left( {{\text{R}}^{{{\text{3}}^{-}}}} \right)$, $\rm A$错误;
$\rm B$.$\rm b$点溶液成分为$\text{Na}{{\text{H}}_{\text{2}}}\text{R}$,由图可知,溶液呈酸性,则$\text{H}{{\text{R}}^{\text{2}}}^{-}$的电离程度大于$\text{H}{{\text{R}}^{\text{2}}}^{-}$的水解程度,即${c}\left( {{\text{R}}^{\text{3-}}} \right)\gt {c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)$,又$\rm HR^{2-}$电离常数为$\rm 1.0\times 10^{-6.4}$,即电离程度很小,所以${c}\left( \text{H}{{\text{R}}^{{2-}}} \right)\gt {c}\left( {{\text{R}}^{ {3-}}} \right)$,则离子浓度大小顺序为${c}\left( \text{N}{{\text{a}}^{+}} \right)\gt {c}\left( \text{H}{{\text{R}}^{{2-}}} \right)\gt {c}\left( {{\text{R}}^{ {3-}}} \right)\gt {c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)$, $\rm B$错误;
$\rm C$.${{\text{R}}^{ {3-}}}$的水解常数$=\dfrac{{{ {K}}_{\text{w}}}}{{{ {K}}_{{{\text{a}}_{\text{3}}}}}}=\dfrac{\text{1}\text{.0}\times \text{1}{{\text{0}}^{ {-14}}}}{\text{1}\text{.0}\times \text{1}{{\text{0}}^{ {-6}\text{.4}}}} =1 \text{.0}\times \text{1}{{\text{0}}^{ {-7}\text{.6}}}$, $\rm C$错误;
$\rm D$.常温下$\text{N}{{\text{a}}_{\text{2}}}\text{HR}$溶液加水稀释过程中,$\text{H}{{\text{R}}^{{2-}}}$的水解常数保持不变,加水稀释过程中$c\text{(O}{{\text{H}}^{-}}\text{)}$增大,$\dfrac{{c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)}{{c}\left( \text{H}{{\text{R}}^{{2-}}} \right)}=\dfrac{{c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)\cdot c\text{(O}{{\text{H}}^{-}}\text{)}}{{c}\left( \text{H}{{\text{R}}^{{2-}}} \right)\cdot c\text{(O}{{\text{H}}^{-}}\text{)}}=\dfrac{{{ {K}}_{\text{b}}}}{ c\text{(O}{{\text{H}}^{-}}\text{)}}$,则$\dfrac{{c}\left( {{\text{H}}_{\text{2}}}{{\text{R}}^{-}} \right)}{{c}\left( \text{H}{{\text{R}}^{{2-}}} \right)}$减小, $\rm D$正确。
故选:$\rm D$
高中 | 盐类水解常数题目答案及解析(完整版)
