高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
$\rm 25\;\rm ^\circ\rm C$时,向$\rm Na_{2}CO_{3}$溶液中滴入盐酸,混合溶液的$\rm pH$与离子浓度变化的关系如图所示。已知:$\lg X=\lg\dfrac{c\left( \text{CO}_{\text{3}}^{2-} \right)}{c\left( \text{HCO}_{\text{3}}^{-} \right)}$或$ \lg\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)}{c\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)}$,下列叙述正确的是$(\qquad)$
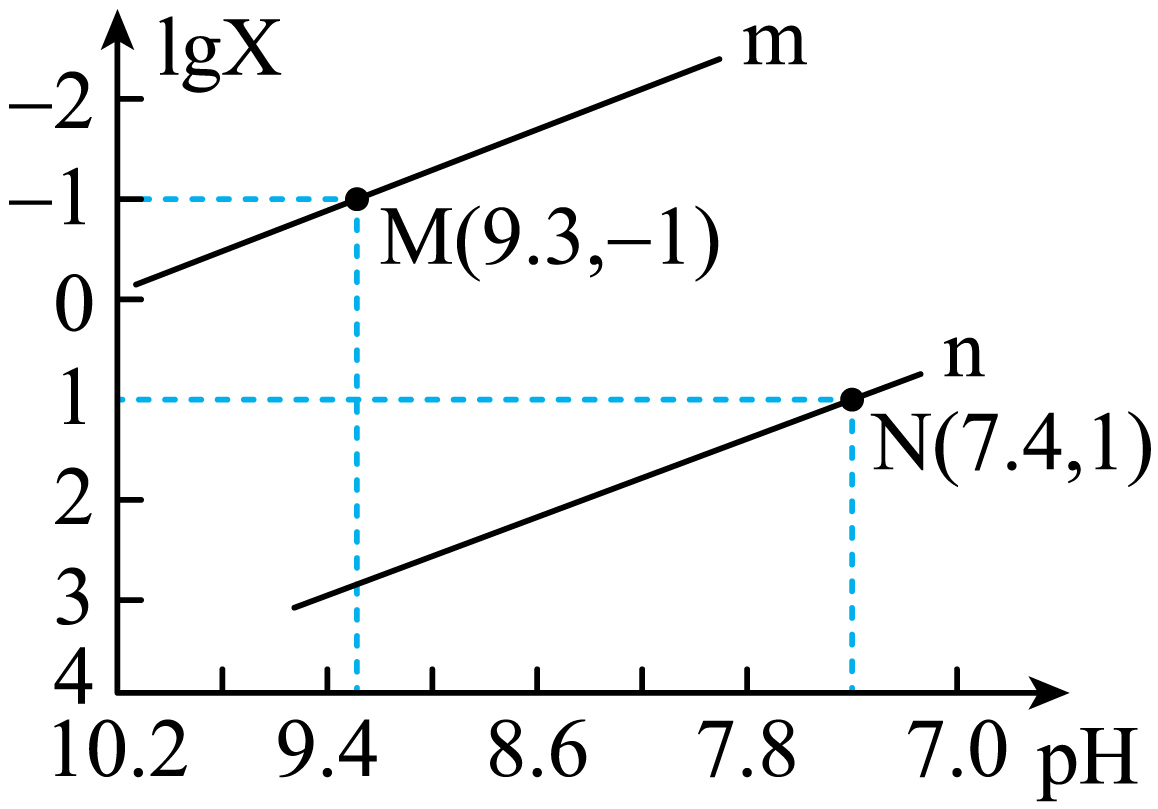
曲线$\\rm m$表示$\\rm pH$与$\\lg\\dfrac{c\\left( \\text{HCO}_{\\text{3}}^{-} \\right)}{c\\left( {{\\text{H}}_{2}}\\text{C}{{\\text{O}}_{3}} \\right)}$的变化关系
","当溶液呈中性时,${c\\rm (Na^{+})}=2c{\\rm (CO_{\\text{3}}^{\\text{2}-}\\rm )}+c\\rm (HCO_{3}^{-}\\rm )$
","$ K\\rm _{a1}(H_{2}CO_{3})$的数量级为$\\rm 10^{-6}$
","$\\rm 25\\;\\rm ^\\circ\\rm C$时,$\\rm CO_{\\text{3}}^{\\text{2}-}\\rm +H_{2}O\\rightleftharpoons \\rm HCO_{3}^{-}\\rm +OH^{-}$的平衡常数为$1.0\\times {{10}^{-3.7}}$
"]碳酸的一级电离平衡常数的$K_{\rm a1}=\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)c\left( {{\text{H}}^{+}} \right)}{c\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)}$,二级电离平衡常数为$K_{2}=\dfrac{c\left( \text{CO}_{\text{3}}^{2-} \right)c\left( {{\text{H}}^{+}} \right)}{c\left( \text{HCO}_{\text{3}}^{-} \right)}$,且$K_{1}\gt \gt K_{2}$,所以当氢离子浓度相同,即$\rm pH$相同时$ \dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)}{c\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)}\gt \dfrac{c\left( \text{CO}_{\text{3}}^{2-} \right)}{c\left( \text{HCO}_{\text{3}}^{-} \right)}$,也就是$ \lg\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)}{c\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)} \gt \lg\dfrac{c\left( \text{CO}_{\text{3}}^{2-} \right)}{c\left( \text{HCO}_{\text{3}}^{-} \right)}$,所以曲线$\rm n$代表$\lg\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)}{c\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)}$,曲线$\rm m$代表$\lg\dfrac{c\left( \text{CO}_{\text{3}}^{2-} \right)}{c\left( \text{HCO}_{\text{3}}^{-} \right)}$。
$\rm A$.根据分析可知$m$表示$\rm pH$与$\lg \dfrac{c\left( \text{CO}_{\text{3}}^{2-} \right)}{c\left( \text{HCO}_{\text{3}}^{-} \right)}$的变化关系,故$\rm A$错误;
$\rm B$.溶液中存在电荷守恒:$ c{\rm(Na^{+})}+c{\rm(H^{+})}=c{\rm(OH^{-})}+2c{\rm(CO_{\text{3}}^{\text{2}-}\rm )}+c{\rm(HCO_{3}^{-}\rm )}+c{\rm(Cl^{-})}$,溶液呈中性,则$ c{\rm(H^{+})}=c{\rm(OH^{-})}$,所以$ c{\rm(Na^{+})}=2c{\rm(CO_{\text{3}}^{\text{2}-}\rm )}+c{\rm(HCO_{3}^{-}\rm )}+c{\rm(Cl^{-})}$,故$\rm B$错误;
$\rm C$.${K\rm _{a1}(H_{2}CO_{3})}=\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)c\left( {{\text{H}}^{+}} \right)}{c\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)}$,根据图象可知$\lg \dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)}{c\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)}\rm =1$时,$\rm pH=7.4$,即$\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)}{c\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)}\rm =10$时$ c\rm (H^{+})=10^{-7.4}\;\rm mol/L$,带入表达式可得$ K\rm _{a1}(H_{2}CO_{3})=10^{-6.4}$,数量级为$\rm 10^{-7}$,故$\rm C$错误;
$\rm D$.$\rm CO_{\text{3}}^{\text{2}-}\rm +H_{2}O\rightleftharpoons \rm HCO_{3}^{-}\rm +OH^{-}$的平衡常数$ K_{\rm h}=\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)c\left( \text{O}{{\text{H}}^{-}} \right)}{c\left( \text{CO}_{\text{3}}^{2-} \right)}$,据图可知$\lg \dfrac{c\left( \text{CO}_{\text{3}}^{2-} \right)}{c\left( \text{HCO}_{\text{3}}^{-} \right)}\rm =-1$时,$\rm pH=9.3$,即$\dfrac{c\left( \text{HCO}_{\text{3}}^{-} \right)}{c\left( \text{CO}_{\text{3}}^{2-} \right)}\rm =10$时,$c\rm (OH^{-})=10^{-4.7}$,带入表达式可得$K_\rm {h}=110^{-3.7}$,故$\rm D$正确。
故选:$\rm D$
高中 | 盐类水解常数题目答案及解析(完整版)
