高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
常温下,某实验小组以酚酞为指示剂,用$\text{0}\text{.1000 mol/L NaOH}$溶液滴定$\text{20}\text{.00 mL 0}\text{.1000 mol/L }{{\text{H}}_{\text{2}}}\text{A}$溶液。溶液$\rm pH$、所有含$\rm A$微粒的分布分数$\rm \delta[$如$\rm HA^{-}$的分布分数:$\delta \left( \text{H}{{\text{A}}^{-}} \right)=\dfrac{c\text{(H}{{\text{A}}^{-}}\text{)}}{c\text{(总含}\text{A}微粒\text{)}}\rm ]$ 随滴加$\rm NaOH$溶液体积$V\left( \text{NaOH} \right)$的变化关系如图所示,下列说法正确的是$(\quad\ \ \ \ )$
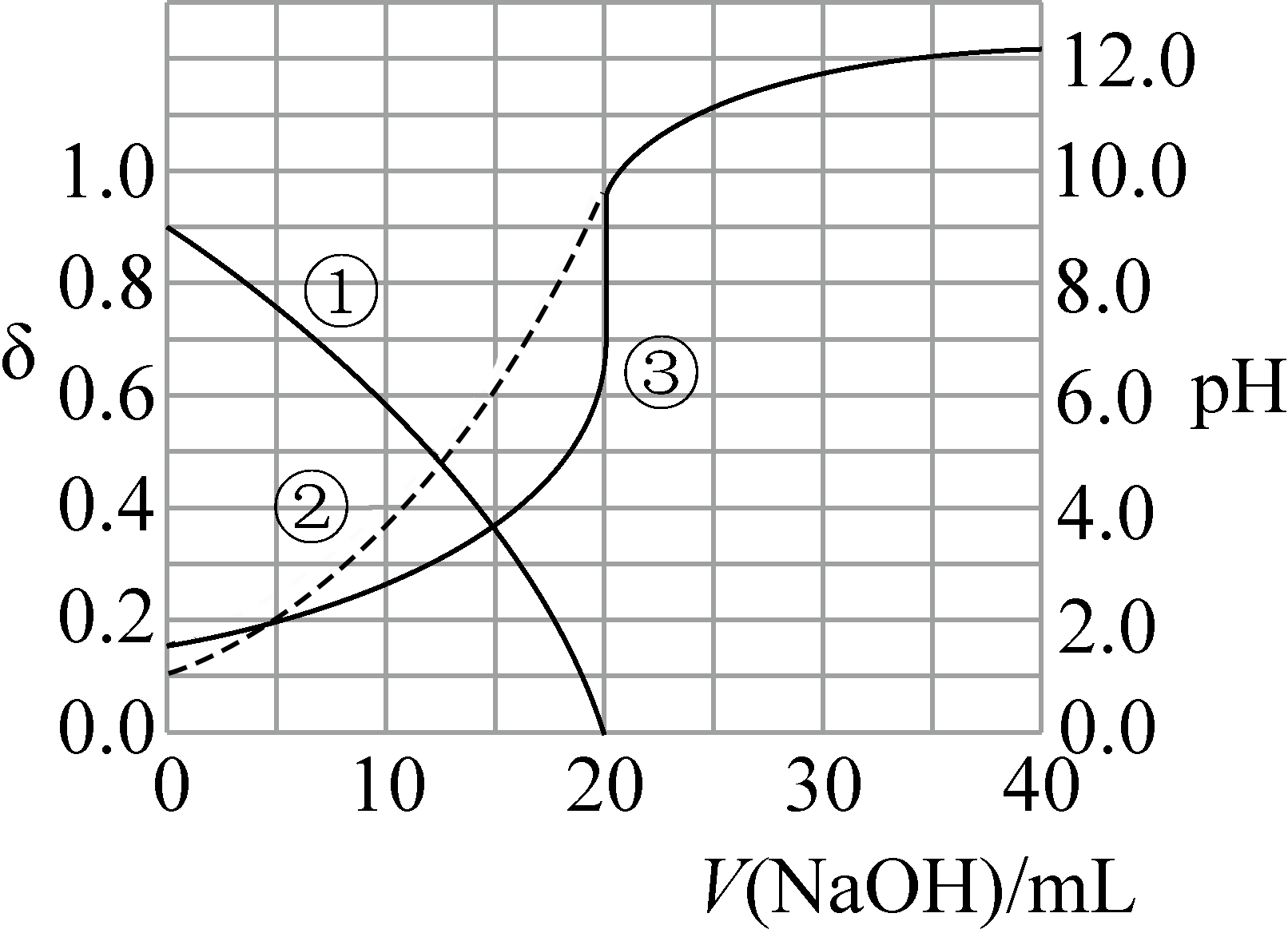
曲线①代表$\\delta \\left( \\text{H}{{\\text{A}}^{-}} \\right)$,曲线②代表$\\delta \\left( {{\\text{A}}^{2-}} \\right)$
","$\\rm NaHA$是酸式盐,其水溶液显碱性
","常温下,$\\rm HA^{-}$的水解常数${{K}_{\\text{h}}}\\approx 1.0\\times {{10}^{-9}}$
","当滴定至中性时,溶液中存在:$c(\\text{H}{{\\text{A}}^{-}})+c\\left( {{\\text{H}}_{\\text{2}}}\\text{A} \\right)\\gt c\\left( \\text{N}{{\\text{a}}^{+}} \\right)$
"]分析:根据图中信息$\text{20}\text{.00 mL 0}\text{.1000 mol/L }{{\text{H}}_{\text{2}}}\text{A}$溶液消耗了$\text{20 mL 0}\text{.1000 mol/L NaOH}$溶液,说明$\rm H_{2}A$为一元弱酸,则曲线①代表$\delta \left( {{\text{H}}_{\text{2}}}\text{A} \right)$,曲线②代表$\delta \left( \text{H}{{\text{A}}^{-}} \right)$。
$\rm A$.根据前面分析,曲线①代表$\rm \delta(H_{2}A)$,曲线②代表$\delta \left( \text{H}{{\text{A}}^{-}} \right)$,故$\rm A$错误;
$\rm B$.$\rm H_{2}A$ 为一元弱酸,因此$\rm NaHA$是正盐,故$\rm B$错误;
$\rm C$.曲线①和曲线②的交叉点,对应的$\rm pH$为$\rm 3$,常温下,$\rm HA-$的水解常数${{K}_{\text{h}}}=\dfrac{c({{\text{H}}_{\text{2}}}\text{A})\cdot c(\text{O}{{\text{H}}^{-}})}{c(\text{H}{{\text{A}}^{-}})}=c(\text{O}{{\text{H}}^{-}})=1\times {{10}^{-11}}$,故$\rm C$错误;
$\rm D$.当滴定至中性时,再根据电荷守恒得到,$c(\text{H}{{\text{A}}^{-}})=c\left( \text{N}{{\text{a}}^{+}} \right)$,则溶液中存在:$c(\text{H}{{\text{A}}^{-}})+c\left( {{\text{H}}_{\text{2}}}\text{A} \right)\gt c\left( \text{N}{{\text{a}}^{+}} \right)$,故$\rm D$正确。
故选:$\rm D$
高中 | 盐类水解常数题目答案及解析(完整版)
