高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
常温下,稀释$0.1\;\rm \text{mol}/\text{L}$的$\text{NaHS}{{\text{O}}_{3}}$溶液,图中的横坐标表示加水的量,则纵坐标可以表示的是$(\quad\ \ \ \ )$
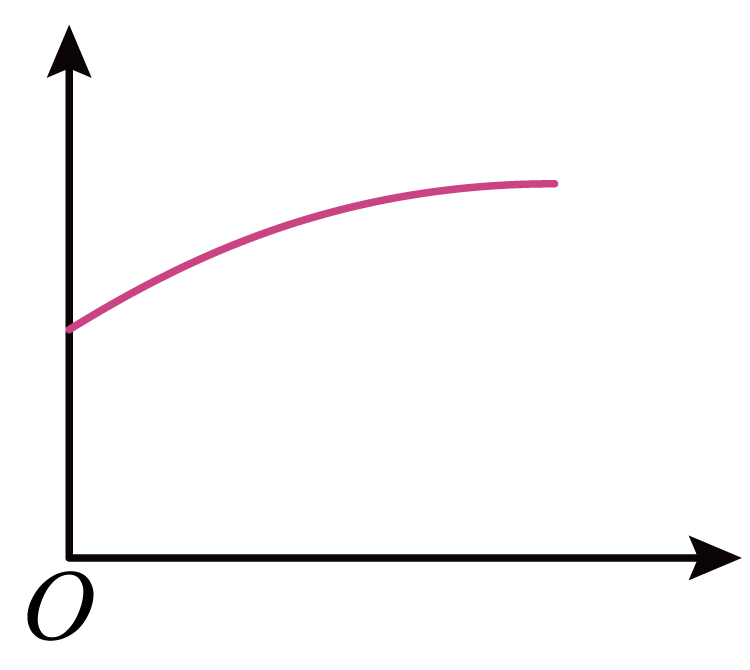
["
$\\text{HSO}_{3}^{-}$的水解平衡常数
","溶液的$\\text{pH}$
","溶液中$n\\left( \\text{HSO}_{3}^{-} \\right)$
","溶液中$c\\left( \\text{N}{{\\text{a}}^{+}} \\right)$
"][["B"]]
$\rm A$.温度一定时,水解的平衡常数为定值,$\rm A$不符合图像;
$\rm B$.$\text{NaHS}{{\text{O}}_{3}}$溶液电离大于水解,溶液显酸性,加水稀释,根据勒夏特列原理,虽然电离程度增大,但氢离子浓度减小,$\rm pH$增大,$\rm B$符合图像;
$\rm C$.随着水的加入,电离程度增大,溶液中亚硫酸根数目减少,$\rm C$不符合图像;
$\rm D$.随着水的加入,体积增大,$c\left( \text{N}{{\text{a}}^{+}} \right)$减小,$\rm D$不符合图像;
故选:$\rm B$
高中 | 盐类水解常数题目答案及解析(完整版)
去刷题
今日推荐 ![]()
![]()
![]()
