高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
常温下,向$\text{20}\text{.0}\ \text{mL}\ \text{0}\text{.05}\ \text{mol/L}$的${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$和${{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$两种酸溶液中:①分别加水稀释,②分别加入$\text{0}\text{.1}\ \text{mol/L}\ \text{NaOH}$溶液,所得溶液$\rm pH$变化如图所示,下列说法正确的是$(\qquad)$
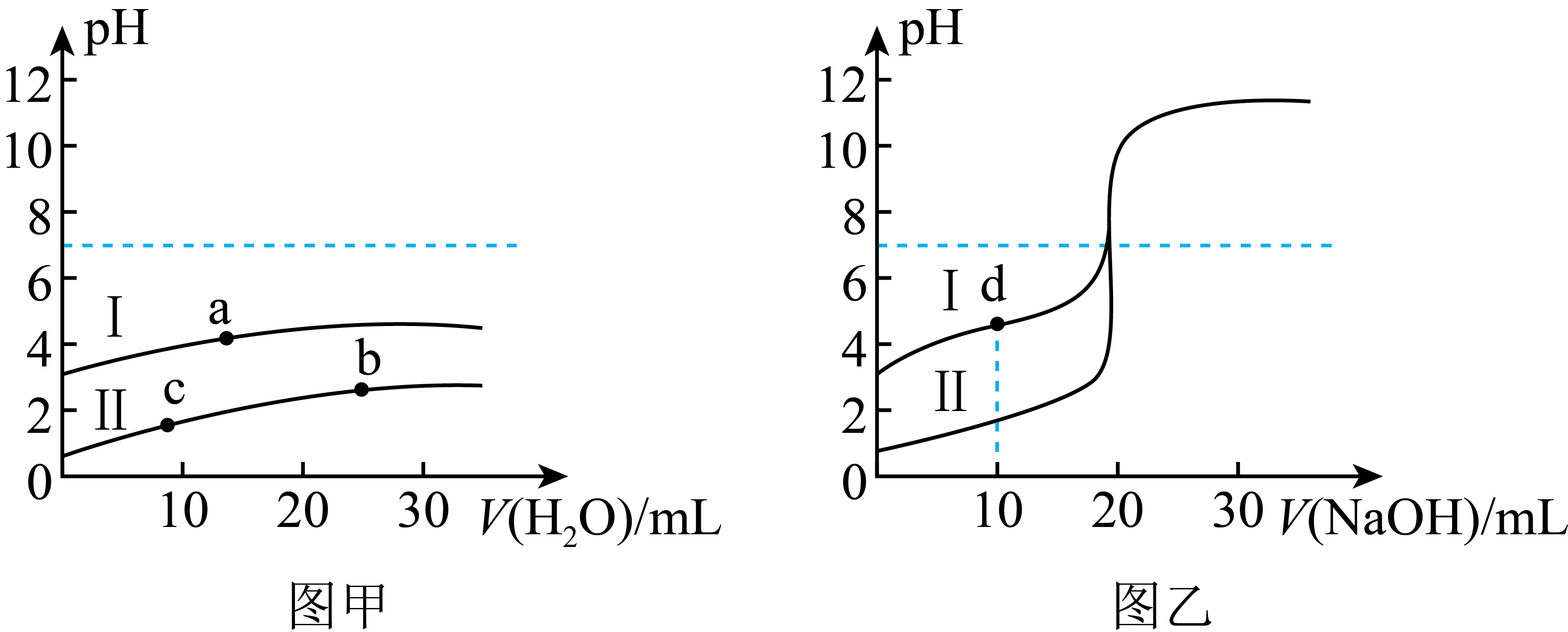
图甲中,中和碱的能力:$\\rm a=b=c$
","图甲中,水的电离程度为:$\\rm a\\lt b\\lt c$
","图乙中,$\\rm d$点溶液中:$c\\text{(N}{{\\text{a}}^{+}})\\gt c\\text{(H}{{\\text{C}}_{\\text{2}}}\\text{O}_{\\text{4}}^{-} {)\\gt c(}{{\\text{C}}_{\\text{2}}}\\text{O}_{\\text{4}}^{{2-}} {)\\gt c(}{{\\text{H}}^{+}} )\\gt c\\text{(O}{{\\text{H}}^{-}}\\text{)}$
","图乙中,$\\text{pH=7}$的两种溶液中:$c\\text{(H}{{\\text{C}}_{\\text{2}}}\\text{O}_{\\text{4}}^{-} {)\\gt c(}{{\\text{C}}_{\\text{2}}}\\text{O}_{\\text{4}}^{{2-}} )\\gt 2c\\text{(SO}_{\\text{4}}^{{2-}}\\text{)}$
"]$\rm A$.${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$为二元强酸,${{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$为弱酸,两者浓度相同时,硫酸中的氢离子浓度大,$\rm pH$值小,结合图象可知$\rm II$为硫酸,$\rm I$为${{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$,$\text{20}\text{.0}\ \text{mL}\ \text{0}\text{.05}\ \text{mol/L}$的${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$和${{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$所含的溶质的物质的量相同,加水稀释后不影响溶质的物质的量,因此$\rm a$、$\rm b$、$\rm c$三点中和碱的能力相同,故$\rm A$正确;
$\rm B$.酸对水的电离起抑制作用,氢离子浓度越大水的电离程度越小,由图可知$ c\rm(H^{+})$:$\rm c\gt b\gt a$,水的电离程度为:$\rm a\gt b\gt c$,故$\rm B$错误;
$\rm C$.$\rm d$点时,${{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$和$\rm NaOH$等物质的量反应,恰好得到$\text{NaH}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$,而此时溶液显酸性,说明$\text{H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-}$的电离程度大于其水解程度,再结合水的电离,则溶液中的离子浓度:$c\text{(N}{{\text{a}}^{+}})\gt c\text{(H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-} {)\gt c(}{{\text{H}}^{+}} {)\gt c(}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{{2-}})\gt c\text{(O}{{\text{H}}^{-}}\text{)}$,故$\rm C$错误;
$\rm D$.$\text{pH=7}$的$\rm II$中溶质为硫酸钠,可知硫酸与氢氧化钠恰好完全反应,此时所加氢氧化钠的体积为$\rm 20\;\rm mL$,根据电荷守恒$c\text{(N}{{\text{a}}^{+}})=2c\text{(SO}_{\text{4}}^{{2-}}\text{)}$,而${{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$中加入$\rm 20\;\rm mL\;\rm NaOH$时生成$\text{N}{{\text{a}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$,此时溶液呈碱性,若使$\rm pH$等于$\rm 7$,则$\rm NaOH$体积小于$\rm 20\;\rm mL$,根据电荷守恒:$c\text{(H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-} {)+2c(}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{{2-}} )=c\text{(N}{{\text{a}}^{+}}\text{)}$,此溶液中的$c\text{(N}{{\text{a}}^{+}}\text{)}$小于$ 2c\text{(SO}_{\text{4}}^{{2-}}\text{)}$,因此:$ 2c\text{(SO}_{\text{4}}^{{2-}})\gt c\text{(H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-} {)+2c(}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{{2-}}\text{)}$,故$\rm D$错误。
故选:$\rm A$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
