高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
${{\text{H}}_{2}}\text{A}$为二元酸,其电离过程为:${{\text{H}}_{2}}\text{A}\rightleftharpoons {{\text{H}}^{+}}+\text{H}{{\text{A}}^{-}},\text{H}{{\text{A}}^{-}}\rightleftharpoons {{\text{H}}^{+}}+{{\text{A}}^{{{2-}}}}$。常温时,向$10\;\rm \text{mL}\;\rm 0.1\;\rm \text{mol}/\text{L}\ {{\text{H}}_{2}}\text{A}$水溶液中逐滴滴加$0.1\;\rm \text{mol}/\text{L\ NaOH}$溶液,混合溶液中${{\text{H}}_{2}}\text{A}、\text{H}{{\text{A}}^{-}}$和${{\text{A}}^{2-}}$的物质的量分数$\left( \delta \right)$随$\text{pH}$变化的关系如图所示。下列说法正确的是$(\qquad)$
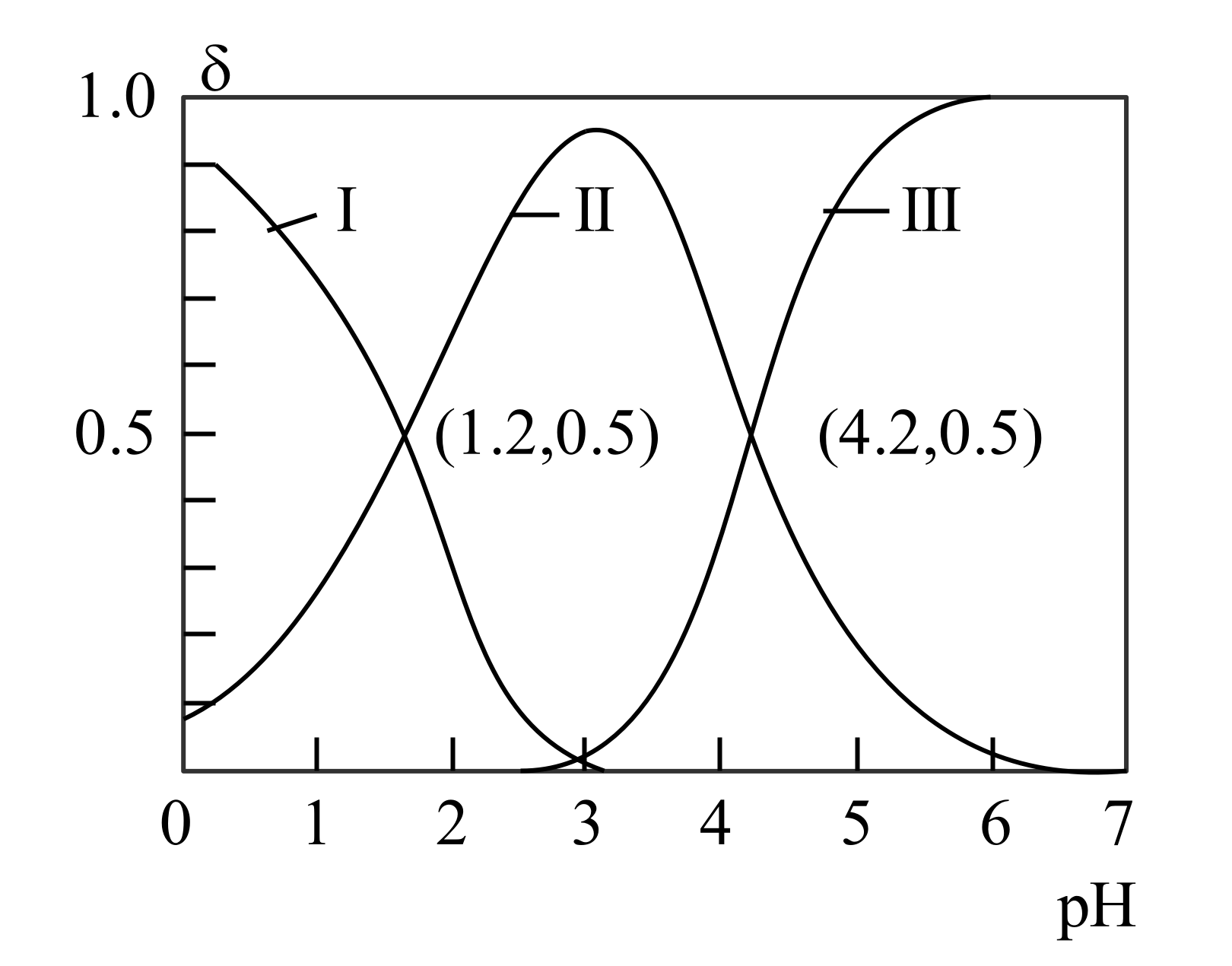
${{\\text{H}}_{2}}\\text{A}$的${{{K}}_{\\text{al}}}$的数量级为${{10}^{-1}}$
","当溶液中${c}\\left( {{\\text{H}}_{2}}\\text{A} \\right)={c}\\left( {{\\text{A}}^{2-}} \\right)$时,$\\text{pH}=2.9$
","当溶液中${c}\\left( \\text{N}{{\\text{a}}^{+}} \\right)=2{c}\\left( {{\\text{A}}^{2}} \\right)+{c}\\left( \\text{H}{{\\text{A}}^{-}} \\right)$时,加入$ V(\\rm NaOH$溶液$\\rm )\\gt 10\\;\\rm mL$
","向$\\text{pH}=4.2$的溶液中继续滴加$\\text{NaOH}$溶液,水的电离程度减小
"]${{\text{H}}_{2}}\text{A}$为二元酸,其电离过程为:${{\text{H}}_{2}}\text{A}\rightleftharpoons {{\text{H}}^{+}}\text{H}{{\text{A}}^{-}}$,$\text{H}{{\text{A}}^{-}}\rightleftharpoons {{\text{H}}^{+}}{{\text{A}}^{2-}}$。常温时,向$\text{1}0\;\rm \text{mL}\;\rm 0.{1\;\rm mol}/\text{L}\ {{\text{H}}_{2}}\text{A}$水溶液中逐滴滴加$0.{1\;\rm mol}/\text{L\ NaOH}$溶液,混合溶液中${{\text{H}}_{2}}\text{A}$、$\text{H}{{\text{A}}^{-}}$和${{\text{A}}^{2-}}$的物质的量分数$\left( \delta \right)$随$\text{pH}$变化的关系如图所示,分析可知,Ⅰ为${{\text{H}}_{2}}\text{A}$含量变化曲线,Ⅱ为$\text{H}{{\text{A}}^{-}}$含量变化曲线,Ⅲ为${{\text{A}}^{2-}}$含量变化曲线。Ⅰ和Ⅱ的交点处,氢离子浓度即为此二元酸的第一级电离常数值,Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,结合溶液中的三大守恒分析即可。
$\rm A$.根据分析${{\text{H}}_{2}}\text{A}$的${{{K}}_{\text{al}}}\rm ={{10}^{-1.2}}$,数量级为${{10}^{-2}}$,$\rm A$错误;
$\rm B$.根据分析,$ K_{\rm a1}(\rm H_{2}A)=10^{-1.2}$,同理$ K_{\rm a2}(\rm H_{2}A)=10^{-4.2}$,当$ c{\rm (H_{2}A)}=c{\rm (A^{2-})}$时,${{{K}}_{\text{a1}}}\times {{{K}}_{\text{a2}}}={{{c}}^{2}}\text{(}{{\text{H}}^{+}})$,此时$ c(\rm H^{+})=1\times 10^{-2.7}\;\rm mol/L$,$\rm pH=2.7$,$\rm B$错误;
$\rm C$.当溶液中${c}\left( \text{N}{{\text{a}}^{+}} \right)=2{c}\left( {{\text{A}}^{2-}} \right)+{c}\left( \text{H}{{\text{A}}^{-}} \right)$时,由电荷守恒分析此时溶液呈现中性,向$\text{1}0\;\rm \text{mL}\;\rm 0.{1\;\rm mol}/\text{L}\ {{\text{H}}_{2}}\text{A}$水溶液中逐滴滴加$0.{1\;\rm mol}/\text{L\ NaOH}$溶液,若加入$\text{NaOH}$溶液体积等于$\rm 10\;\rm mL$,此时形成$\rm NaHA$溶液,其电离大于水解,溶液呈现酸性,故应在$\rm 10\;\rm mL$的基础上多加$\text{NaOH}$溶液才有可能呈现中性,故加入$ V(\rm NaOH$溶液$\rm )\gt 10\;\rm mL$,$\rm C$正确;
$\rm D$.向$\text{pH}=4.2$的溶液中继续滴加$\rm NaOH$溶液,结合图分析,$\text{H}{{\text{A}}^{-}}$含量再减小,${{\text{A}}^{2-}}$含量增大,故水的电离程度在增大,而氢氧化钠溶液过量则会导致水的电离受到抑制,故水的电离程度先变大后减小,$\rm D$错误;
故选:$\rm C$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
