高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
室温下,向$\rm 10\;\rm mL\;\rm 0.1\;\rm mol/L\;NaOH$溶液中加入$\rm 0.1\;\rm mol/L$的一元酸$\rm HA$ 溶液,$\rm pH$的变化曲线如图所示。下列说法正确的是$(\qquad)$
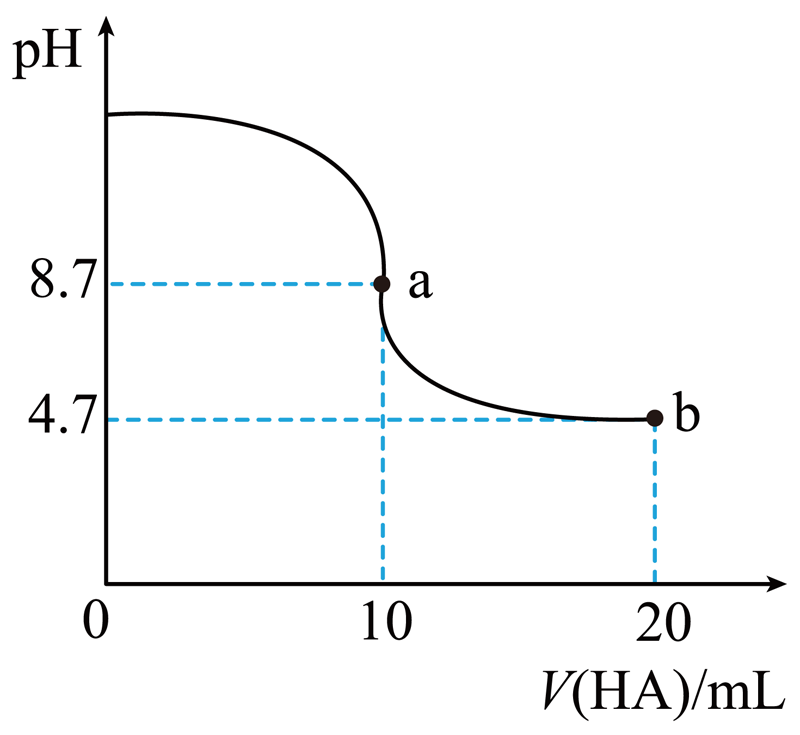
$\\rm a$点所示溶液中${c\\rm (Na^{+})}\\gt c\\rm (A^{-})$
","$\\rm pH=7$时,$c{\\rm(Na^{+})}=c{\\rm(A^{-})}+c{\\rm(HA)}$
","$\\rm b$点所示溶液中$c{\\rm(A^{-})}+c{\\rm(OH^{-})}=c{\\rm(HA)}+c{\\rm(H^{+})}$
","$\\rm a$、$\\rm b$两点所示溶液中水的电离程度:$\\rm a\\lt b$
"]$\rm A$.$\rm a$点时酸碱恰好中和,溶液$\rm pH=8.7$,说明$\rm HA$为弱酸,$\rm NaA$溶液水解呈碱性,应为$c{\rm(Na^{+})}\gt c{\rm(A^{-})}$,选项$\rm A$正确;
$\rm B$.$\rm pH=7$时,$c{\rm(H^{+})}=c{\rm(OH^{-})}$,由电荷守恒可知$c{\rm(Na^{+})}+c{\rm(H^{+})}=c{\rm(A^{-})}+c{\rm(OH^{-})}$,则$c{\rm(Na^{+})}=c{\rm(A^{-})}$,选项$\rm B$错误;
$\rm C$.$\rm b$点$\rm HA$过量一倍,溶液为等浓度的$\rm NaA$和$\rm HA$混合溶液,溶液呈酸性,由物料守恒有$ 2c{\rm(Na^{+})}=c{\rm(A^{-})}+c{\rm(HA)}$,由电荷守恒可知$c{\rm(Na^{+})}+c{\rm(H^{+})}=c{\rm(A^{-})}+c{\rm(OH^{-})}$,两式联立得$c{\rm(A^{-})}+2c{\rm(OH^{-})}=c{\rm(HA)}+2c{\rm(H^{+})}$,选项$\rm C$错误;
$\rm D$.$\rm a$点$\rm A^{-}$水解,促进水的电离,$\rm b$点时$\rm HA$过量,溶液呈酸性,$\rm HA$电离出$\rm H^{+}$,抑制水的电离,$\rm a$、$\rm b$两点所示溶液中水的电离程度:$\rm a\gt b$,选项$\rm D$错误。
故选:$\rm A$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
