高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
常温下,用$0.01\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\text{ NaOH}$标准溶液滴定$20\;\rm \text{mL }0.01\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$三元酸${{\text{H}}_{3}}\text{A}\rm ({{\text{H}}_{3}}\text{A}$的第一步电离方程式为${{\text{H}}_{3}}\text{A}={{\text{H}}^{+}}+{{\text{H}}_{2}}{{\text{A}}^{-}}\rm )$,测得溶液的$\text{pH}$与氢氧化钠溶液体积的关系如图所示,下列说法正确的是$(\qquad)$
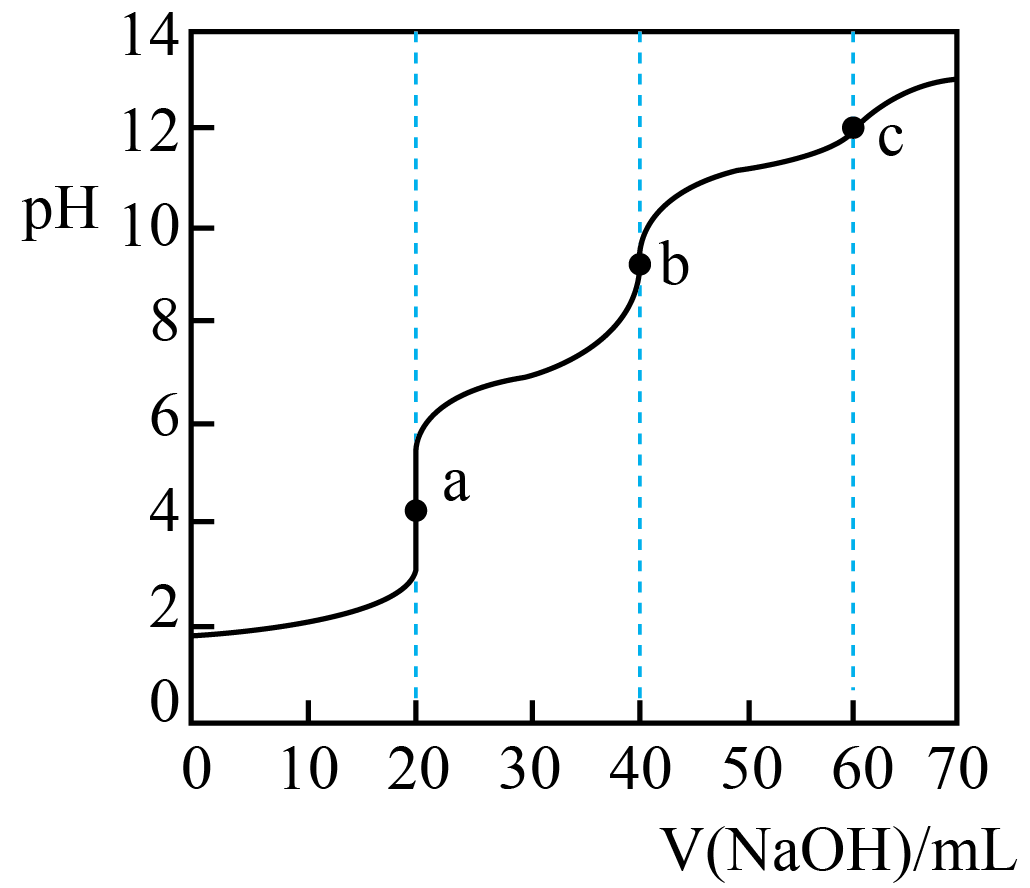
滴定过程中可用石蕊作指示剂
","$\\rm a$点满足:$c\\left( \\text{N}{{\\text{a}}^{+}} \\right)\\lt c\\left( \\text{H}{{\\text{A}}^{2-}} \\right)+c\\left( {{\\text{H}}_{2}}{{\\text{A}}^{-}} \\right)+c\\left( {{\\text{A}}^{3-}} \\right)$
","$\\rm b$点满足:$c\\left( \\text{N}{{\\text{a}}^{+}} \\right)+c\\left( {{\\text{H}}^{+}} \\right)\\gt c\\left( \\text{H}{{\\text{A}}^{2-}} \\right)+c\\left( {{\\text{H}}_{2}}{{\\text{A}}^{-}} \\right)+c\\left( {{\\text{A}}^{3-}} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
","随着氢氧化钠溶液的不断加入,水的电离程度不断增大
"]$\rm A$.由图像可知,滴定过程在$\rm pH$为$\rm 5$、$\rm 9$和$\rm 11$左右时存在滴定终点,而石蕊的变色范围为$\rm 5\sim 8$,所以滴定过程中不可用石蕊作指示剂,故$\rm A$错误;
$\rm B$.$\rm a$点时,加入$\rm NaOH$溶液的体积为$\rm 20\;\rm mL$,$\rm NaOH$与$\rm H_{3}A$恰好完全反应生成$\rm NaH_{2}A$,由物料守恒可知$c\left( \text{N}{{\text{a}}^{+}} \right)=c\left( {{\text{H}}_{3}}\text{A} \right)+c\left( \text{H}{{\text{A}}^{2-}} \right)+c\left( {{\text{H}}_{2}}{{\text{A}}^{-}} \right)+c\left( {{\text{A}}^{3-}} \right)$,则$c\left( \text{N}{{\text{a}}^{+}} \right)\gt c\left( \text{H}{{\text{A}}^{2-}} \right)+c\left( {{\text{H}}_{2}}{{\text{A}}^{-}} \right)+c\left( {{\text{A}}^{3-}} \right)$,故$\rm B$错误;
$\rm C$.$\rm b$点时,加入$\rm NaOH$溶液的体积为$\rm 40\;\rm mL$,$\rm NaOH$与$\rm H_{3}A$恰好完全反应生成$\rm Na_{2}HA$,由电荷守恒可知$c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)=2c\left( \text{H}{{\text{A}}^{2-}} \right)+c\left( {{\text{H}}_{2}}{{\text{A}}^{-}} \right)+3c\left( {{\text{A}}^{3-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,则$c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)\gt c\left( \text{H}{{\text{A}}^{2-}} \right)+c\left( {{\text{H}}_{2}}{{\text{A}}^{-}} \right)+c\left( {{\text{A}}^{3-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,故$\rm C$正确;
$\rm D$.加入氢氧化钠溶液$\rm 0\sim 20\;\rm mL$时,$\rm H_{3}A$电离产生的$ c\rm (H^{+})$不断减小,水的电离程不断增大,$\rm 20\sim 60\;\rm mL$时,溶液中先后生成$\rm HA^{2-}$、$\rm A^{3-}$,$\rm HA^{2-}$、$\rm A^{3-}$水解促使水的电离程度不断增大,大于$\rm 60\;\rm mL$时,过量的氢氧化钠抑制水的电离,使水的电离程度不断减小,所以随着氢氧化钠溶液的不断加入,水的电离程度先增大后减小,故$\rm D$错误。
故选:$\rm C$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
1、常温下,用标准溶液滴定
三元酸
的第一步电离方程式为
,测得溶液的
与氢氧化钠溶液体积的关系如图所示,下列说法正确的是

滴定过程中可用石蕊作指示剂
点满足:
点满足:
随着氢氧化钠溶液的不断加入,水的电离程度不断增大
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
免责声明:
① 凡本站注明“稿件来源:高途”的所有文字、图片和音视频稿件,版权均属本网所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他方式复制发表。已经本站协议授权的媒体、网站,在下载使用时必须注明“稿件来源:高途”,违者本站将依法追究责任。
② 本站注明稿件来源为网络的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者在两周内速来电或来函联系。
为二元酸,其电离过程为:。常温时,向水溶液中逐滴滴加溶液,混合溶液中和的物质的量分数随变化的关系如图所示。下列说法正确的是
常温下,向溶液中滴加溶液,混合溶液中表示或随变化如图,已知,Ⅰ线和Ⅱ线交点横坐标为,下列说法错误的是
室温下,向溶液中加入的一元酸 溶液,的变化曲线如图所示。下列说法正确的是
部分弱电解质的电离平衡常数如表:
室温下,用溶液滴定或的稀溶液,溶液与的关系如图所示,已知:,室温下,下列说法错误的是
下列叙述中正确的是




