高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
中国自古有“信口雌黄”、“雄黄入药”之说。雌黄$\rm (As_{2}S_{3})$和雄黄$\rm (As_{4}S_{4})$都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。
砷元素有$\rm +2$、$\rm +3$两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
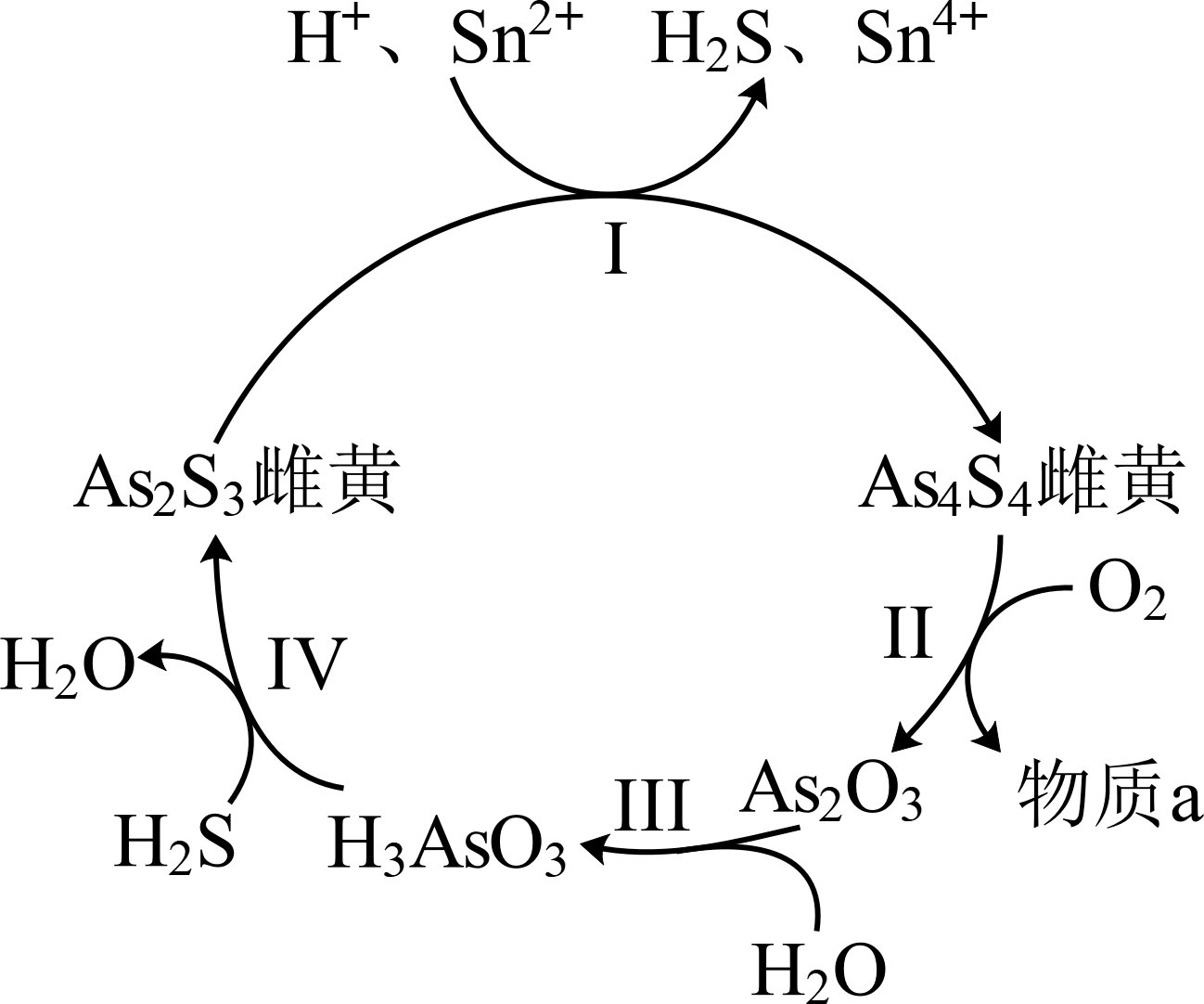
①Ⅰ中,氧化剂是 。
②Ⅱ中,若$\rm 1$ $\rm mol$ $\rm As_{4}S_{4}$反应转移$\rm 28$ $\rm mol$ $\rm e^{-}$,则反应Ⅱ的化学方程式是 。
$\\rm As_{2}S_{3}$ ; $\\rm As_{4}S_{4}+7O_{2}\\begin{array}{c} {\\underline{\\underline{}}}\\\\{一定条件} \\end{array}\\text{2A}{{\\text{s}}_{\\text{2}}}{{\\text{O}}_{\\text{3}}}\\text{+4S}{{\\text{O}}_{\\text{2}}}$
"]]①Ⅰ中$\rm Sn$的化合价升高,$\rm As$的化合价降低,所以$\rm As_{2}S_{3}$在反应中得电子作氧化剂;
②Ⅱ中,若$\rm 1$ $\rm mol$ $\rm As_{4}S_{4}$反应转移$\rm 28$ $\rm mol$ $\rm e^{-}$,则反应消耗$\rm 7\;\rm mol$氧气,反应的方程式为: $\rm As_{4}S_{4}+7O_{2}\begin{array}{c} {\underline{\underline{}}}\\{一定条件} \end{array}\text{2A}{{\text{s}}_{\text{2}}}{{\text{O}}_{\text{3}}}\text{+4S}{{\text{O}}_{\text{2}}}$;
Ⅲ中产物亚砷酸$\rm (H_{3}AsO_{3})$可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的$\rm pH$关系如图所示。
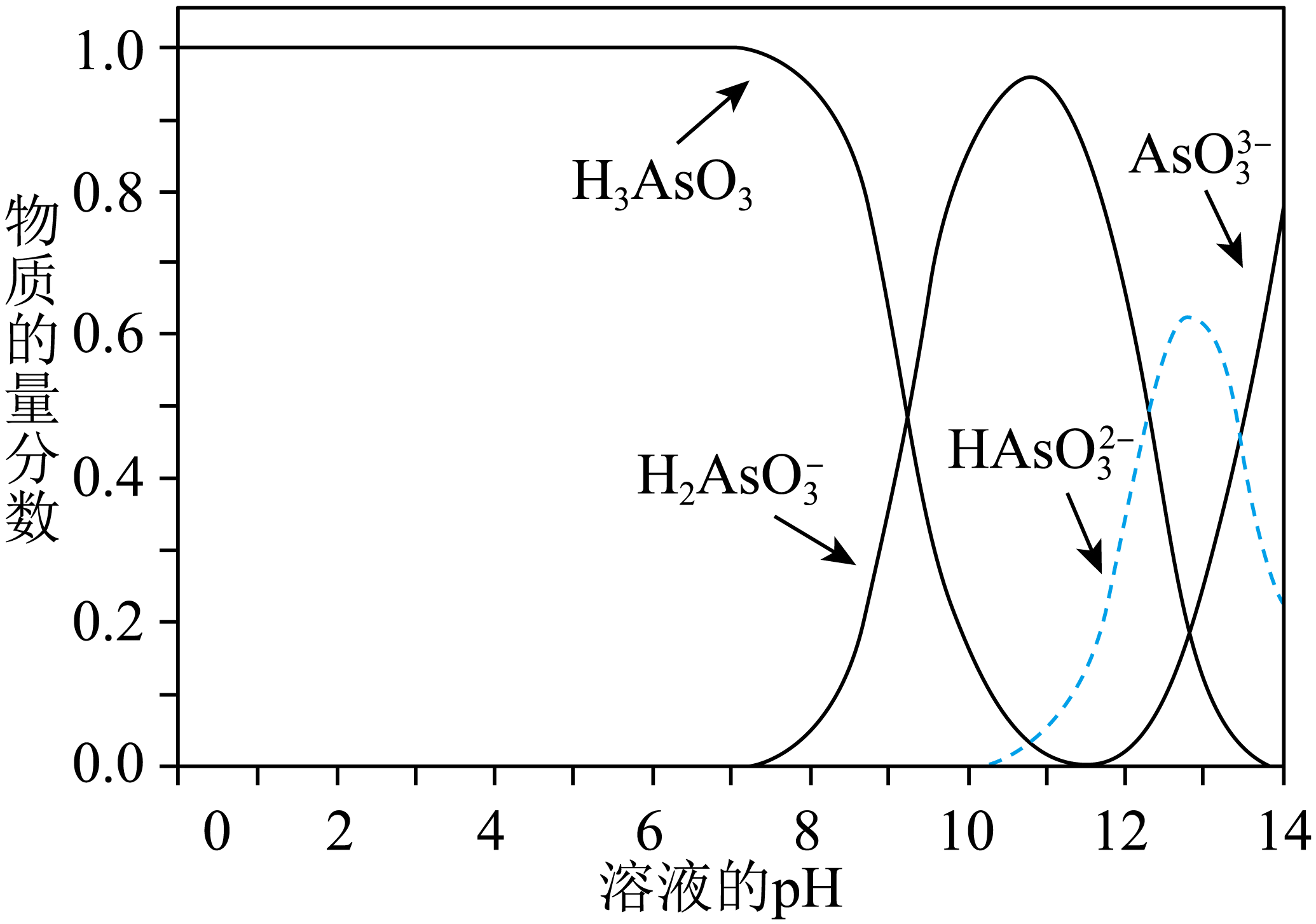
①人体血液的$\rm pH$在$\rm 7.35$~$\rm 7.45$之间,用药后人体中含砷元素的主要微粒是 。
②将$\rm KOH$溶液滴入亚砷酸溶液,当$\rm pH$调至$\rm 11$时发生反应的离子方程式是 。
③下列说法正确的是 $\rm ($填字母序号$\rm )$。
$\text{a}$. $n\left( {{\text{H}}_{\text{3}}}\text{As}{{\text{O}}_{\text{3}}} \right):n\left( {{\text{H}}_{\text{2}}}\text{AsO}_{3}^{-} \right)=1:1$时,溶液显碱性
$\text{b}$. $\rm pH=12$时,溶液中$c\left( {{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-} \right)+2c\left( \text{HAsO}_{\text{3}}^{\text{2-}} \right)+3c\left( \text{AsO}_{\text{3}}^{\text{3-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)c\left( {{\text{H}}^{+}} \right)$
$\text{c}$. 在$\rm K_{3}AsS_{3}$溶液中,$c\left( \text{AsO}_{\text{3}}^{\text{3-}} \right)\gt c\left( \text{HAsO}_{\text{3}}^{\text{2-}} \right)\gt c\left( {{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-} \right)$
$\\rm H_{3}AsO_{3}$ ; ${{\\text{H}}_{\\text{3}}}\\text{As}{{\\text{O}}_{\\text{3}}}\\text{+O}{{\\text{H}}^{-}}={{\\text{H}}_{\\text{2}}}\\text{AsO}_{\\text{3}}^{-}+{{\\text{H}}_{\\text{2}}}\\text{O}$ ; $ \\!\\!\\text{ ac}$
"]]①根据图象可知,$\rm pH$在$\rm 7.35$~$\rm 7.45$之间,溶液中含砷元素的主要微粒是$\rm H_{3}AsO_{3}$;
②将$\rm KOH$溶液滴入亚砷酸溶液,当$\rm pH$调至$\rm 11$时,亚砷酸与氢氧根离子反应生成${{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-}$,其反应的离子方程式为:${{\text{H}}_{\text{3}}}\text{As}{{\text{O}}_{\text{3}}}\text{+O}{{\text{H}}^{-}}={{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-}+{{\text{H}}_{\text{2}}}\text{O}$;
③$\text{a}$. $n\left( {{\text{H}}_{\text{3}}}\text{As}{{\text{O}}_{\text{3}}} \right):n\left( {{\text{H}}_{\text{2}}}\text{AsO}_{3}^{-} \right)=1:1$时,溶液的$\rm pH=9$,所以溶液显碱性,故$\text{a}$正确;
$\text{b}$. $\rm pH=12$时,溶液显碱性,$c\left( \text{O}{{\text{H}}^{-}} \right)\gt c\left( {{\text{H}}^{+}} \right)$,所以$c\left( {{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-} \right)+2c\left( \text{HAsO}_{\text{3}}^{\text{2-}} \right)+3c\left( \text{AsO}_{\text{3}}^{\text{3-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)\gt c\left( {{\text{H}}^{+}} \right)$,故$\text{b}$错误;
$\text{c}$. 在$\rm K_{3}AsS_{3}$溶液中,存在三步水解,以第一步水解为主,第一步水解生成$\text{HAsO}_{\text{3}}^{\text{2-}}$,第二步水解生成${{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-}$,则$c\left( \text{AsO}_{\text{3}}^{\text{3-}} \right)\gt c\left( \text{HAsO}_{\text{3}}^{\text{2-}} \right)\gt c\left( {{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-} \right)$,故$\text{c}$正确;
工业含砷$\rm (III)$废水常用铁盐处理后排放,其原理是:铁盐混凝剂在溶液中生产$\rm Fe(OH)_{3}$胶粒,其表面带有正电荷,可吸附含砷化合物。经测定不同$\rm pH$条件下铁盐对含砷$\rm ($Ⅲ$\rm )$化合物的去除率如图所示。$\rm pH$在$\rm 5$~$\rm 9$之间时,随溶液$\rm pH$增大,铁盐混凝剂对含砷$\rm ($Ⅲ$\rm )$化合物的吸附效果增强。结合$(2)$和$(3)$中图示解释可能的原因: 。
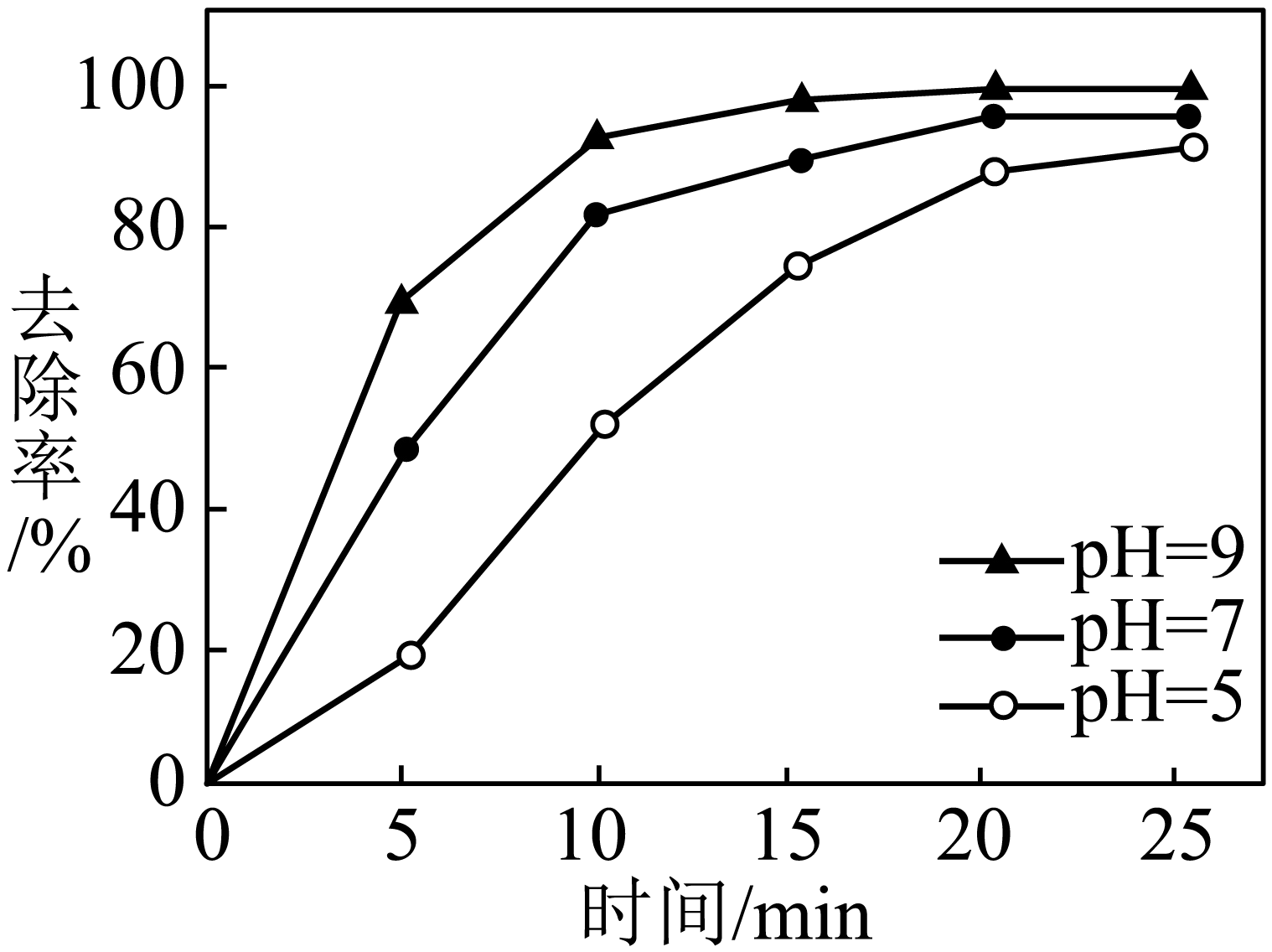
$\\rm pH=5$~$\\rm 9$之间溶液中主要存在微粒为$\\rm H_{3}AsO_{3}$和${{\\text{H}}_{\\text{2}}}\\text{AsO}_{\\text{3}}^{-}$,由于$\\rm Fe(OH)_{3}$胶粒表面带正电荷,可以吸附负电荷,${{\\text{H}}_{\\text{2}}}\\text{AsO}_{\\text{3}}^{-}$随着溶液中$\\rm pH$的增大而增多,${{\\text{H}}_{\\text{2}}}\\text{AsO}_{\\text{3}}^{-}$含量多,吸附效果好,此外,$\\rm pH$升高有利于水解,促进$\\rm Fe(OH)_{3}$的生成,$\\rm Fe(OH)_{3}$的含量高,吸收效果更好
"]]铁盐混凝剂在溶液中生产$\rm Fe(OH)_{3}$胶粒,其表面带有正电荷,可吸附含砷化合物;由$(2)$图可知,$\rm pH$在$\rm 7.35$~$\rm 7.45$溶液中主要存在微粒为$\rm H_{3}AsO_{3}$和${{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-}$,而且${{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-}$随着溶液中$\rm pH$的增大而增多,${{\text{H}}_{\text{2}}}\text{AsO}_{\text{3}}^{-}$含量越多,静电作用的吸附性更强,此外,$\rm pH$升高有利于水解,促进$\rm Fe(OH)_{3}$的生成,$\rm Fe(OH)_{3}$的含量高,吸收效果更好。
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
