高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
某工业废水中含有大量${{\text{H}}^{+}}$、$\text{N}{{\text{a}}^{+}}$、$\text{C}{{\text{u}}^{2+}}$、$\text{C}{{\text{l}}^{-}}$、$\text{SO}_{4}^{2-}$、$\text{NO}_{3}^{-}$。某小组同学为除去该废水样品中的$\text{C}{{\text{u}}^{2+}}$和$\text{SO}_{4}^{2-}$,最终得到中性溶液,设计了如图所示的实验方案。
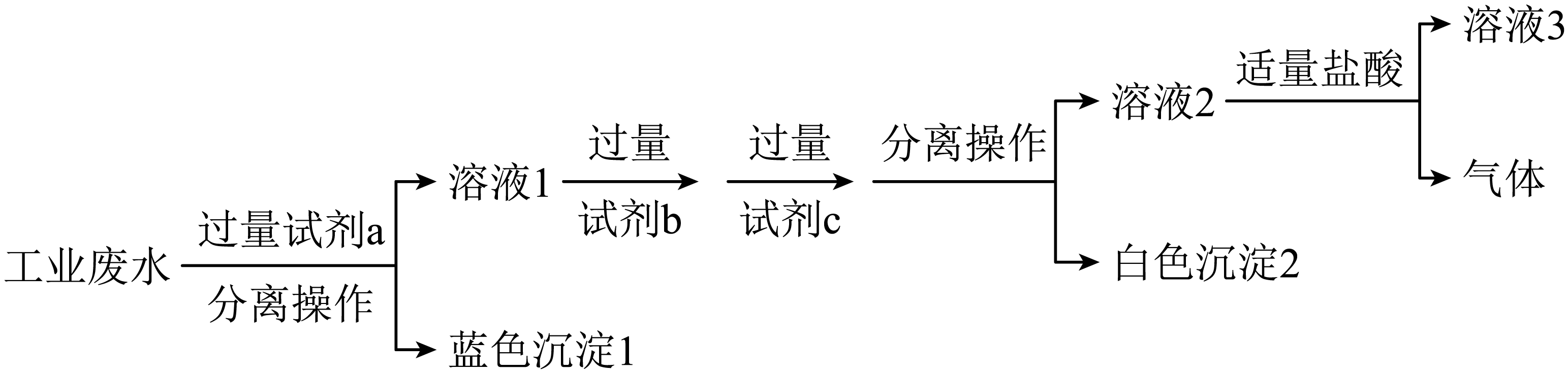
下列说法不正确的是$\rm (\qquad)$
试剂$\\rm a$、试剂$\\rm b$、试剂$\\rm c$可分别为$\\rm NaOH$、$\\rm \\text{BaC}{{\\text{l}}_{2}}$、$\\rm \\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{O}}_{3}}$
","分离操作所需用到的玻璃仪器主要有漏斗、烧杯、玻璃棒
","向白色沉淀$\\rm 2$中加入过量盐酸,沉淀部分溶解
","溶液$\\rm 3$中$\\rm \\text{N}{{\\text{a}}^{+}}$和$\\rm \\text{C}{{\\text{l}}^{-}}$的数目相等
"]加过量试剂$\rm a$生成蓝色沉淀,蓝色测定是氢氧化铜,则试剂$\rm a$是$\rm NaOH$,溶液$\rm 1$中加过量氯化钡生成硫酸钡沉淀除$\rm \text{SO}_{4}^{2-}$,加过量碳酸钠生成碳酸钡沉淀除过量的钡离子,过滤出硫酸钡和碳酸钡沉淀,溶液$\rm 2$中加适量盐酸除过量的氢氧化钠和碳酸钠得到二氧化碳气体和中性溶液$\rm 3$。
$\rm A$.根据以上分析,试剂$\rm a$、试剂$\rm b$、试剂$\rm c$可分别为$\rm NaOH$、$\rm \text{BaC}{{\text{l}}_{2}}$、$\rm \text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$,故$\rm A$正确;
$\rm B$.分离操作实现固液分离,分离操作为过滤,过滤用到的玻璃仪器主要有漏斗、烧杯、玻璃棒,故$\rm B$正确;
$\rm C$.白色沉淀$\rm 2$是硫酸钡和碳酸钡,加入过量盐酸,碳酸钡溶解、硫酸钡不溶解,故$\rm C$正确;
$\rm D$.溶液$\rm 3$中含有$\rm \text{N}{{\text{a}}^{+}}$和$\rm \text{C}{{\text{l}}^{-}}$、$\rm \text{NO}_{3}^{-}$,根据电荷守恒,$\rm \text{N}{{\text{a}}^{+}}$和$\rm \text{C}{{\text{l}}^{-}}$数目不相等,故$\rm D$错误。
故选:$\rm D$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
