高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
为测定空气中$\text{C}{{\text{O}}_{2}}$的含量,某小组同学将一定体积的空气样品通入$\rm 100\;\rm mL$一定浓度的$\rm NaOH$溶液中制成待测溶液。随后用如图$\rm 1$所示装置,向待测溶液中逐滴加入$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$的盐酸,并用压强传感器测得装置内压强随加入盐酸体积的变化曲线如图$\rm 2$所示。
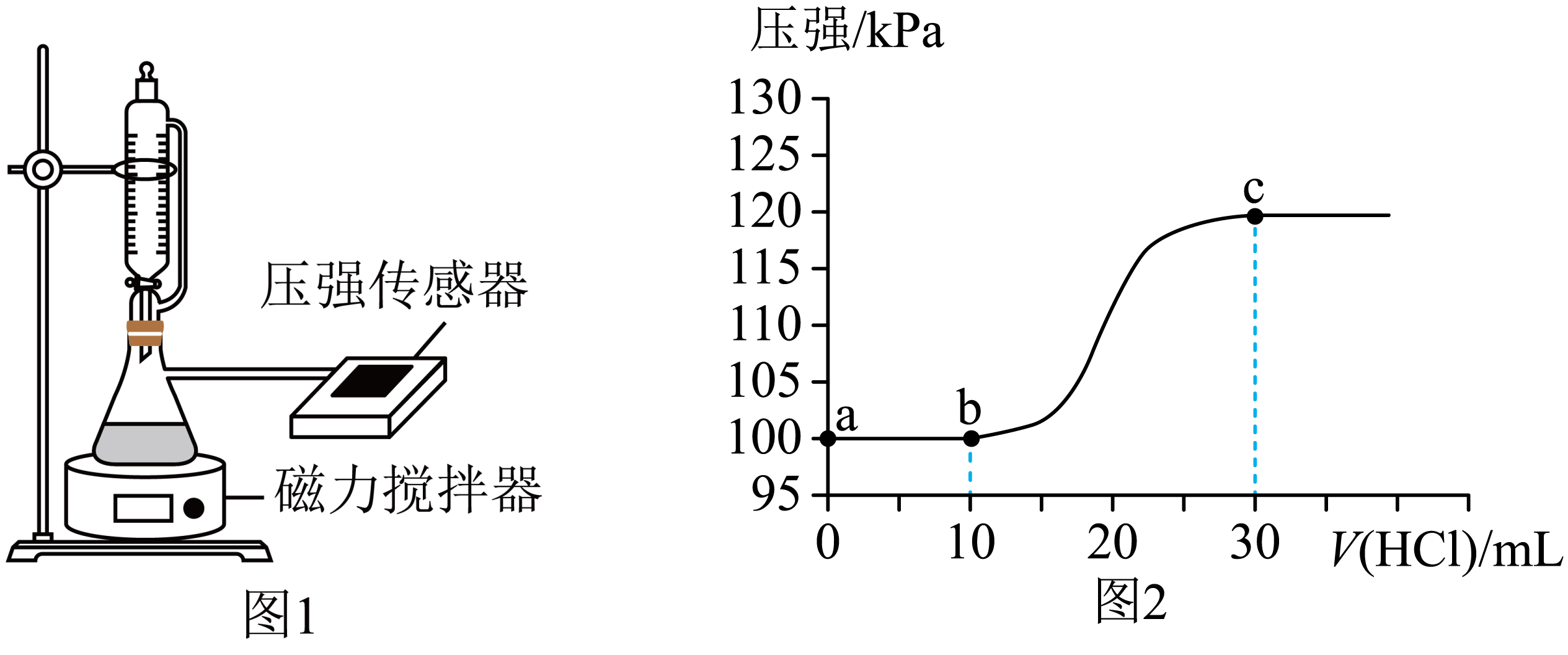
假定实验过程中装置内温度没有变化,忽略气体的溶解。下列说法不正确的是$\rm (\qquad)$
$\\rm a$点对应的溶液呈碱性
","$\\rm c$点对应的溶液中${c}\\left( \\text{N}{{\\text{a}}^{+}} \\right)={c}\\left( \\text{C}{{\\text{l}}^{-}} \\right)$
","从$\\rm a$点到$\\rm c$点,溶液中${c}\\left( \\text{CO}_{3}^{2-} \\right)+{c}\\left( \\text{HCO}_{3}^{-} \\right)+{c}\\left( {{\\text{H}}_{2}}\\text{C}{{\\text{O}}_{3}} \\right)$为定值
","加入盐酸前,待测溶液中$\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{O}}_{3}}$和$\\text{NaHC}{{\\text{O}}_{3}}$的物质的量浓度之比为$1:1$
"]由图可知,溶液中滴加盐酸时先发生反应:$\text{CO}_{\text{3}}^{\text{2-}}+{{\text{H}}^{+}}\text{=HCO}_{3}^{-}$,然后发生$\text{HCO}_{\text{3}}^{-}+{{\text{H}}^{+}}\text{=C}{{\text{O}}_{\text{2}}}\uparrow +{{\text{H}}_{\text{2}}}\text{O}$,滴入的$\rm 10\;\rm mL$盐酸和碳酸钠反应,再滴入的$\rm 20\;\rm mL$盐酸与碳酸氢钠反应,根据离子方程式可知,$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$和$\text{NaHC}{{\text{O}}_{3}}$的物质的量之比为$\rm 1:1$,两者的浓度之比也为$\rm 1: 1$。
$\rm A$.根据分析,$\rm a$点为碳酸钠和碳酸氢钠的混合溶液,碳酸钠和碳酸氢钠水解,溶液呈碱性,$\rm A$正确;
$\rm B$.$\rm c$点碳酸氢钠与盐酸恰好完全反应,溶质为氯化钠,故${c}\left( \text{N}{{\text{a}}^{+}} \right)={c}\left( \text{C}{{\text{l}}^{-}} \right)$,$\rm B$正确;
$\rm C$.$\rm a$点为等物质的量的$\rm \text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$和$\rm \text{NaHC}{{\text{O}}_{3}}$混合溶液,从$\rm a$点到$\rm c$点,溶液中存在物料守恒:$ {2c\rm(N}{{\text{a}}^{+}} {)=3 } [ { c}\left( \text{CO}_{3}^{2-} \right)+{c}\left( \text{HCO}_{3}^{-} \right)+{c}\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)]$,随着溶液体积增大, ${c}\left( \text{CO}_{3}^{2-} \right)+{c}\left( \text{HCO}_{3}^{-} \right)+{c}\left( {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}} \right)$逐渐减小,$\rm C$错误;
$\rm D$.根据分析,加入盐酸前,待测溶液中$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$和$\text{NaHC}{{\text{O}}_{3}}$的物质的量浓度之比为$\rm 1:1$,$\rm D$正确。
故选:$\rm C$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
