高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
以$\rm 0.1\ mol/L\ NaOH$溶液滴定$\rm 20.00\ mL\ 0.1\ mol/L\ {{H}_{3}}P{{O}_{4}}$溶液的滴定曲线如图。
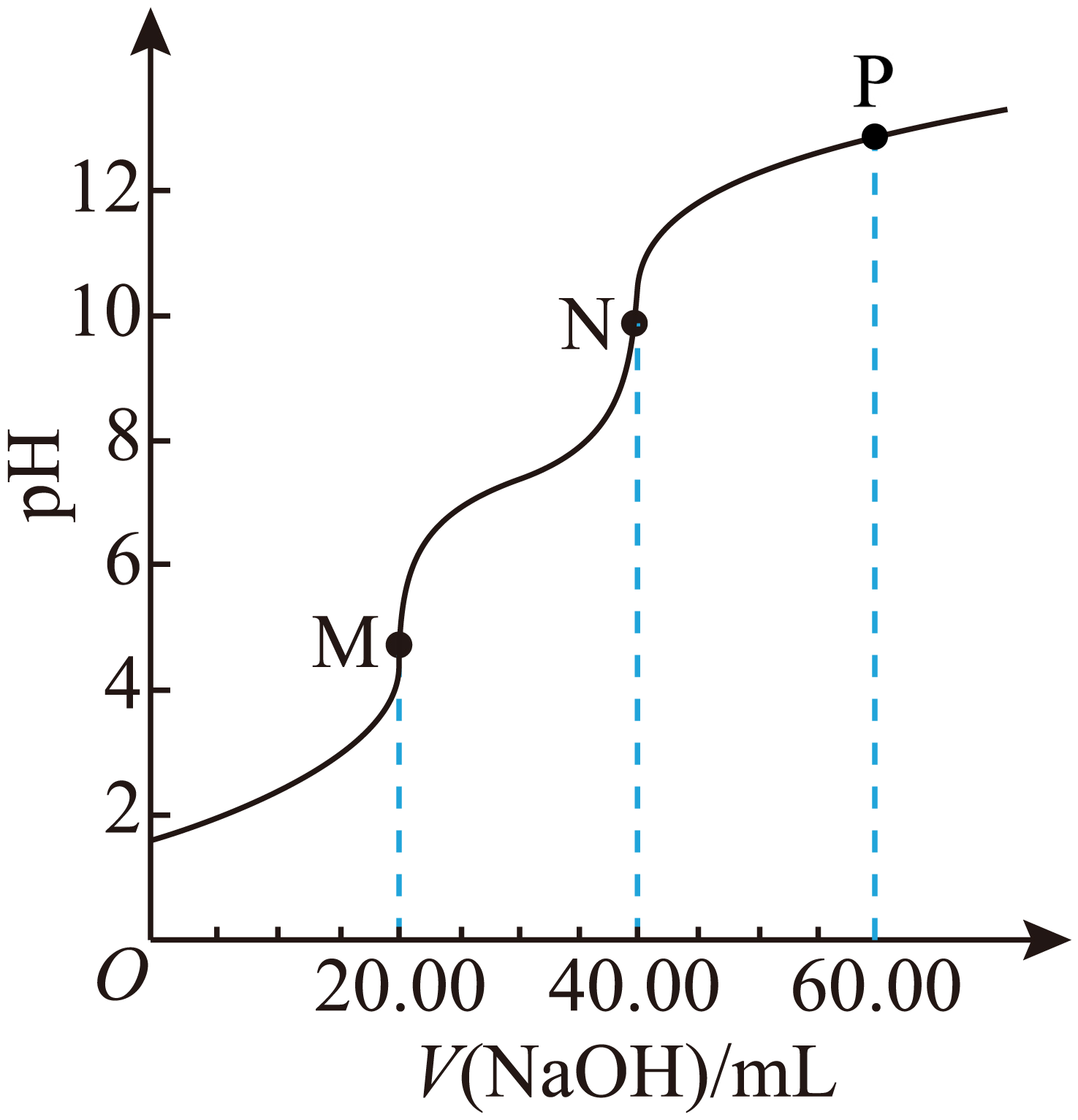
已知:酚酞的变色范围是$\rm pH\ 8.2\sim 10$
下列说法不正确的是$\rm (\qquad)$
$\\rm M$点主要溶质为$\\rm Na{{H}_{2}}P{{O}_{4}}$
","$\\rm N$点可用酚酞作指示剂指示滴定终点
","$\\rm N$点溶液:$c{\\rm (N{{a}^{+}})}\\gt c{\\rm (HPO_{4}^{2-})}\\gt c{\\rm (PO_{4}^{3-})}\\gt c{\\rm ({{H}_{2}}PO_{4}^{-})}$
","$\\rm P$点溶液:$c{\\rm (O{{H}^{-}})}=c{\\rm (HPO_{4}^{2-})}+2c{\\rm ({{H}_{2}}PO_{4}^{-})}+3c{\\rm ({{H}_{3}}P{{O}_{4}})}+c{\\rm ({{H}^{+}})}$
"]$\rm A$.$\rm M$点加入$\rm 0.1\ mol/L$的$\rm NaOH$溶液$\rm 20\ mL$,此时磷酸和氢氧化钠恰好完全反应生成$\rm NaH_{2}PO_{4}$,溶液中主要溶质为$\rm NaH_{2}PO_{4}$,$\rm A$正确。
$\rm B$.$\rm N$点溶质主要为$\rm Na_{2}HPO_{4}$,此时溶液的$\rm pH$略小于$\rm 10$,酚酞的变色范围$\rm pH$:$\rm 8.2-10$,在酚酞变色范围内,$\rm N$点后溶液$\rm pH$大于$\rm 10$,因此可用酚酞作指示剂指示滴定终点,$\rm B$正确。
$\rm C$.$\rm N$点溶液中溶质为$\rm Na_{2}HPO_{4}$,此时溶液呈碱性,说明$\rm HPO_{4}^{2-}$的水解程度大于电离程度,因此$c{\rm (PO_{4}^{3-})}\lt c{\rm ({{H}_{2}}PO_{4}^{-})}$,$\rm C$错误。
$\rm D$.$\rm P$点溶液中溶质为$\rm Na_{3}PO_{4}$,根据质子守恒,水电离出的氢氧根离子数目等于水电离出的氢离子数目,其中氢离子存在于$\rm HPO_{4}^{2-}$、$\rm {{H}_{2}}PO_{4}^{-}$和$\rm {{H}_{3}}P{{O}_{4}}$等物质中,则有$c{\rm (O{{H}^{-}})}=c{\rm (HPO_{4}^{2-})}+2c{\rm ({{H}_{2}}PO_{4}^{-})}+3c{\rm ({{H}_{3}}P{{O}_{4}})}+c{\rm ({{H}^{+}})}$,$\rm D$正确。
故选:$\rm C$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
