高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
$\rm HA$ 为一元弱酸。已知溶液中$\rm HA$、$\rm A^{-}$的物质的量分数$\rm \delta$随溶液$\rm pH$变化的曲线如右图所示。向$\rm 10$ $\rm mL\ 0.1\;\rm mol/L\ HA$溶液中,滴加$\rm 0.1\;\rm mol/L\ NaOH$溶液$x$ $\rm mL$。下列说法中,不正确的是$(\qquad)$
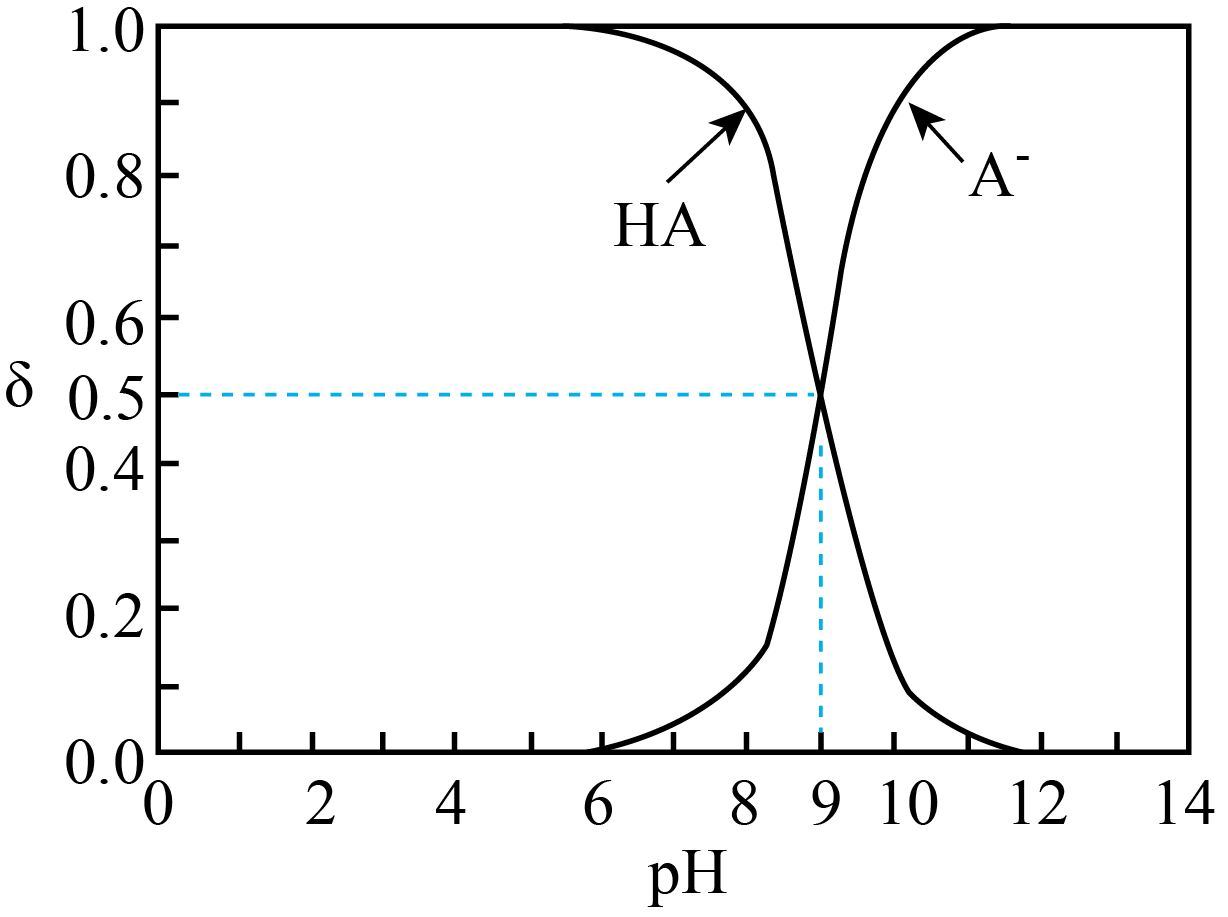
$\\rm pH=9$时,$ c{(\\rm A^{-})}=c(\\rm HA)$
","$ x=0$时,$\\rm 1\\lt pH\\lt 7$
","$ x=5$时,$ c{(\\rm A^{-})}=c(\\rm HA)$
","$ x=10$时,$ c{(\\rm A^{-})}+c{\\rm (HA)}=c{\\rm (Na^{+})}=0.05\\;\\rm mol/L$
"]$\rm A$、根据图象,当$\rm pH=9$时,$ c{(\rm HA)}=(\rm A^{-})$,故$\rm A$说法正确;$\rm B$、$\rm HA$为弱酸,$\rm 0.1\;\rm mol\;\rm HA$的$\rm pH\gt 1$,$\rm HA$为酸,因此$\rm HA$的$\rm pH\lt 7$,故$\rm B$说法正确;$\rm C$、$ x=5$时,此时溶液中的溶质为$\rm NaA$和$\rm HA$,且两者物质的量相等,$\rm A^{-}$的物质的量分数为$\rm 0.5$,根据图象此时$\rm pH=9$,溶液显碱性,即$ c{(\rm A^{-})}\gt c(\rm HA)$,故$\rm C$说法错误;$\rm D$、$ x=10$时,$\rm NaOH$和$\rm HA$恰好完全反应,此时的溶液中溶质为$\rm NaA$,根据物料守恒,因此有$ c{(\rm A^{-})}+c{(\rm HA)}=c{(\rm Na^{+})}$,故$\rm D$说法正确。
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
