高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
电解质在水溶液中的行为影响了电解质溶液的性质$\rm ($以下讨论均在常温附$\rm )$。
$\text{0}\text{.1 mol}\cdot {{\text{L}}^{\text{-1}}}\text{ C}{{\text{H}}_{\text{3}}}\text{COOH}$溶液的$\text{pH=3}$
①$\text{C}{{\text{H}}_{\text{3}}}\text{COOH}$的电离方程式是 。
②该溶液中由水电离出的${{\text{H}}^{+}}$浓度是 $\text{mol}\cdot {{\text{L}}^{\text{-1}}}$。
③计算$\text{C}{{\text{H}}_{\text{3}}}\text{COOH}$的电离平衡常数${{K}_{\text{a}}}=$ 。
$\\rm CH_{3}COOH⇌CH_{3}COO^{-}+H^{+}$ ; $\\rm 10^{-11}$ $\\rm mol/L$ ; $\\rm 10^{-5}$
"]]①$\rm CH_{3}COOH$在水溶液中部分电离生成$\rm CH_{3}COO^{-}$、$\rm H^{+}$,电离方程式为$\rm CH_{3}COOH⇌CH_{3}COO^{-}+H^{+}$;
②该溶液中由水电离出的$c\left( {{\text{H}}^{+}} \right)=\dfrac{{{K}_{\text{w}}}}{c\text{(}{{\text{H}}^{+}}\text{)溶液}}\rm =\dfrac{{{10}^{-14}}}{{{10}^{-3}}}$ $\rm mol/L=10^{-11}$ $\rm mol/L$;
③$\rm CH_{3}COOH$在水溶液中电离程度较小,则$c\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right)\approx 0.1\text{mol/L}$,$c\left( \text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}} \right)\approx c\left( {{\text{H}}^{+}} \right)={{10}^{-3}}\text{ mol/L}$,该温度下$\rm CH_{3}COOH$的电离平衡常数${{K}_{\text{a}}}=\dfrac{{{10}^{-3}}\times {{10}^{-3}}}{\text{0}\text{.1}}\rm =10^{-5}$;
室温下,用$\text{0}\text{.100 mol}\cdot {{\text{L}}^{\text{-1}}}\text{ NaOH}$溶液分别滴定$\text{20}\text{.00 mL 0}\text{.100 mol}\cdot {{\text{L}}^{\text{-1}}}$的盐酸和醋酸,如图所示。
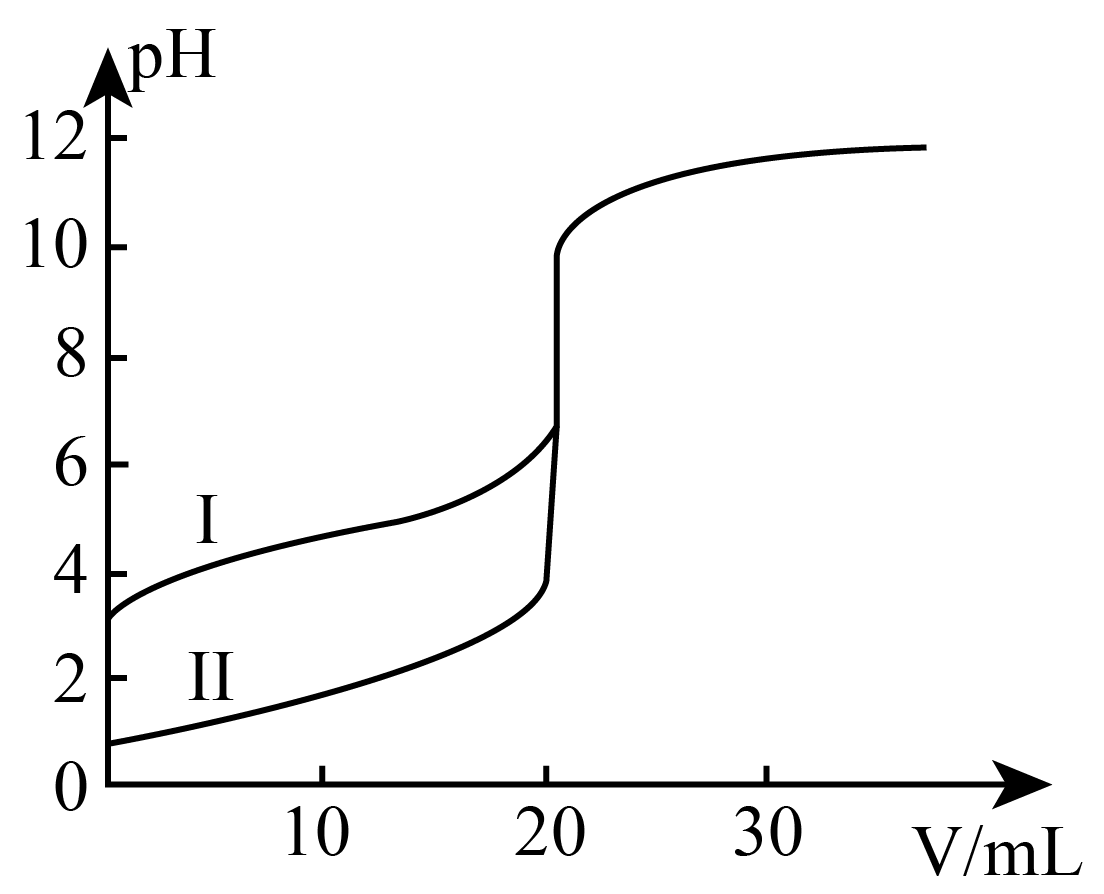
①表示滴定盐酸的曲线是 $\rm ($填$\rm I$或Ⅱ$\rm )$。
②当醋酸中滴入$\text{10 mL NaOH}$溶液时,下列有关溶液的说法正确的是 $\rm ($填字母序号$\rm )$。
$\rm a$.溶质为:$\text{C}{{\text{H}}_{\text{3}}}\text{COOH}、\text{C}{{\text{H}}_{\text{3}}}\text{COONa}$
$\rm b$.微粒浓度满足:$c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)=c\left( \text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$
$\rm c$.微粒浓度满足:$c\left( \text{N}{{\text{a}}^{+}} \right)=c\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right)+c\left( \text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}} \right)$
Ⅱ ; $\\rm ab$
"]]①$\rm HCl$是强电解质,完全电离,$\rm CH_{3}COOH$为弱电解质,部分电离,$\rm 0.100$ $\rm mol/L$ $\rm HCl$、$\rm CH_{3}COOH$溶液中,$\rm pH(HCl)=1$、$\rm pH(CH_{3}COOH)\gt 1$,表示滴定盐酸的曲线是Ⅱ;
②$\rm a$.当醋酸中滴入$\rm 10$ $\rm mL$ $\rm NaOH$溶液时,有一半的醋酸被中和,则溶质为:$\rm CH_{3}COOH$、$\rm CH_{3}COONa$,故$\rm a$正确;
$\rm b$.溶液中存在电荷守恒:$c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)=c\left( \text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,故$\rm b$正确;
$\rm c$.根据物料守恒得$2c\left( \text{N}{{\text{a}}^{+}} \right)=c\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right)+c\left( \text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}} \right)$,则$c\left( \text{N}{{\text{a}}^{+}} \right)\lt c\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right)+c\left( \text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}} \right)$,故$\rm c$错误;
故答案为:$\rm ab$;
${{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$和$\text{HClO}$的电离平衡常数如下:
| 化学式 | ${{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$ | $\text{HClO}$ |
| 电离平衡常数$\rm ({{K}_{\text{a}}}\rm )$ | ${{K}_{{{\text{a}}_{\text{1}}}}}\text{=4}\text{.5}\times \text{1}{{\text{0}}^{\text{-7}}}$ ${{K}_{{{\text{a}}_{\text{2}}}}}\text{=4}\text{.7}\times \text{1}{{\text{0}}^{\text{-11}}}$ | $\text{4}\text{.0}\times \text{1}{{\text{0}}^{\text{-8}}}$ |
①相同物质的量浓度的$\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$、$\text{NaHC}{{\text{O}}_{\text{3}}}$、$\text{NaClO}$溶液,$\text{pH}$由小到大的顺序是 。
②$\text{0}\text{.01 mol}\cdot {{\text{L}}^{\text{-1}}}\text{ NaHC}{{\text{O}}_{\text{3}}}$的溶液中$c\left( {{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}} \right)\gt c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)$,结合化学用语解释其原因: 。
$\\rm NaHCO_{3}\\lt NaClO\\lt Na_{2}CO_{3}$ ; $\\rm 0.01$ $\\rm mol\\cdot L^{-1}$ $\\rm NaHCO_{3}$的溶液中$\\rm HCO_{3}^{-}$水解平衡常数${{K}_{\\text{h}}}=\\dfrac{{{K}_{\\text{w}}}}{{{K}_{\\text{a1}}}} =\\dfrac{{{10}^{-14}}}{4.5\\times {{10}^{-5}}}\\approx 2\\times {{10}^{-10}}\\gt {{K}_{\\text{a2}}}$,说明$\\rm HCO_{3}^{-}$的水解程度大于电离程度
"]]①酸的电离平衡常数越大,酸的酸性越强,其对应的酸根离子水解程度越小,相同物质的量浓度的钠盐溶液的$\rm pH$值越小,根据电离平衡常数知,酸性:$\rm H_{2}CO_{3}\gt HClO\gt HCO_{3}^{-}$,水解程度:$\rm CO_{\text{3}}^{\text{2}-}\rm \gt ClO^{-}\gt HCO_{3}^{-}$,则相同物质的量浓度的$\rm Na_{2}CO_{3}$、$\rm NaHCO_{3}$、$\rm NaClO$溶液,$\rm pH$由小到大的顺序是$\rm NaHCO_{3}\lt NaClO\lt Na_{2}CO_{3}$;
②$\rm 0.01$ $\rm mol\cdot L^{-1}$ $\rm NaHCO_{3}$的溶液中$\rm HCO_{3}^{-}$水解平衡常数${{K}_{\text{h}}}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{a1}}}} =\dfrac{{{10}^{-14}}}{4.5\times {{10}^{-5}}}\approx 2\times {{10}^{-10}}\gt {{K}_{\text{a2}}}$,说明$\rm HCO_{3}^{-}$的水解程度大于电离程度,溶液中$\text{c}\left( {{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}} \right)\text{c}\left( \text{CO}_{\text{3}}^{\text{2-}} \right)$;
$\text{0}\text{.1 mol/L}$的四种溶液:①$\text{C}{{\text{H}}_{\text{3}}}\text{COON}{{\text{H}}_{\text{4}}}$、②$\text{N}{{\text{H}}_{\text{4}}}\text{HC}{{\text{O}}_{\text{3}}}$、③$\text{NaHS}{{\text{O}}_{\text{3}}}$、④$\text{N}{{\text{H}}_{\text{4}}}\text{HS}{{\text{O}}_{\text{3}}}$已知溶液①呈中性,溶液②呈碱性,比较①、②两溶液的酸碱性,可以得出的结论是 。③④水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中$c\left( \text{SO}_{3}^{2-} \right)$较小的是 $\rm ($填溶液序号$\rm )$。
$\\rm HCO_{3}^{-}$的水解程度大于$\\rm NH_{4}^{+}$的水解程度,$\\rm CH_{3}COO^{-}$、$\\rm NH_{4}^{+}$的水解程度相等 ; ④
"]]$\rm CH_{3}COONH_{4}$溶液呈中性,说明$\rm CH_{3}COO^{-}$、$\rm NH_{4}^{+}$的水解程度相等,$\rm NH_{4}HCO_{3}$溶液呈碱性,说明$\rm HCO_{3}^{-}$的水解程度大于$\rm NH_{4}^{+}$的水解程度,比较①、②两溶液的酸碱性,可以得出的结论是:$\rm HCO_{3}^{-}$的水解程度大于$\rm NH_{4}^{+}$的水解程度,$\rm CH_{3}COO^{-}$、$\rm NH_{4}^{+}$的水解程度相等;③的水溶液呈酸性,说明$\rm HSO_{3}^{-}$的电离程度大于水解程度;④的水溶液呈酸性,说明$\rm NH_{4}^{+}$的水解程度大于$\rm HSO_{3}^{-}$的水解程度,由此得出$\rm NH_{4}^{+}$的水解程度大于$\rm HSO_{3}^{-}$的水解程度且$\rm HSO_{3}^{-}$的电离程度大于水解程度,相同条件下,同浓度的③④两种酸式盐中,$\rm NH_{4}^{+}$、
$\rm HSO_{3}^{-}$相互促进水解,水解程度越大,酸式酸根离子电离程度越小,则水溶液中$c\left( \text{SO}_{3}^{2-} \right)$较小是④。
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
