高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
某化学实验小组为了探究氨的氧化性和还原性设计了如下实验方案。
实验一:探究氨的还原性,实验装置如图$\rm 1$所示。
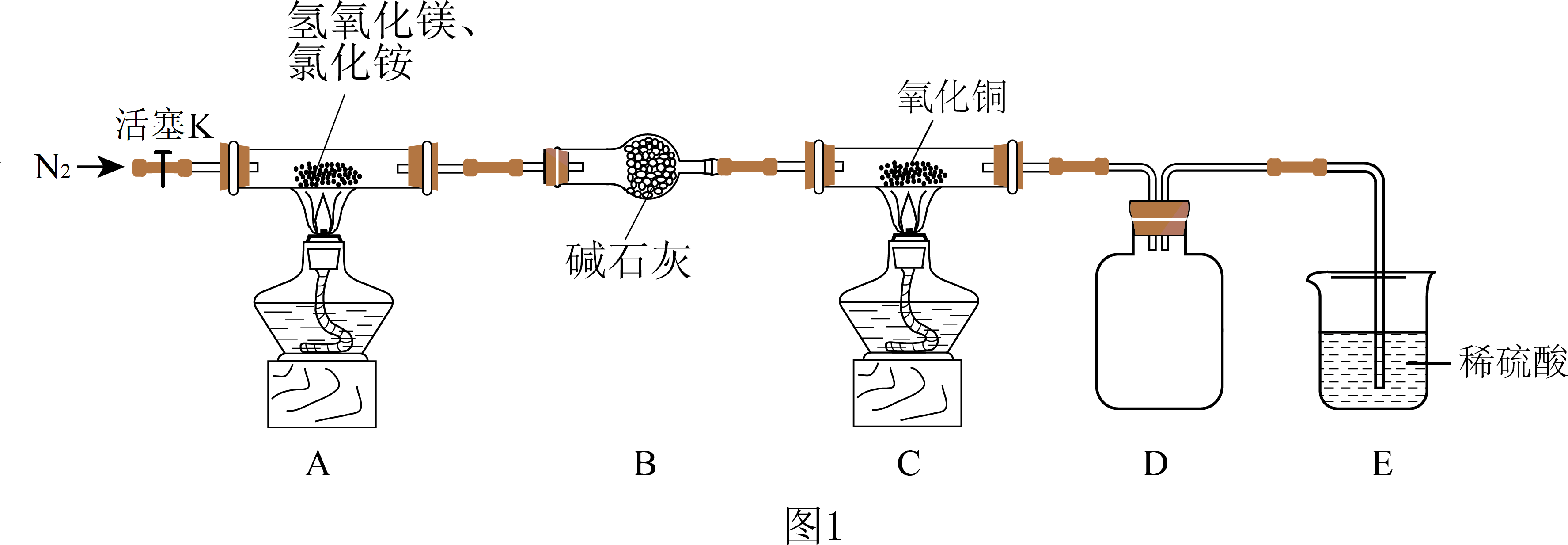
已知:$\rm ($ⅰ$\rm )Mg(OH)_{2}$可代替消石灰与氯化铵在加热条件下反应,生成氨和碱式氯化镁$\rm [Mg(OH)Cl]$;
$\rm ($ⅱ$\rm )Cu_{2}O$粉末呈红色,在酸性溶液中不稳定:$\rm Cu_{2}O+H_{2}SO_{4}($稀$\rm )=Cu+CuSO_{4}+H_{2}O$。
装置$\rm A$中发生反应的化学方程式为 ,装置$\rm D$的作用是 。
$\\text{Mg}{{\\left( \\text{OH} \\right)}_{2}}+\\text{N}{{\\text{H}}_{\\text{4}}}\\text{Cl}\\begin{matrix} \\underline{\\underline{_{\\triangle }}} \\\\ {} \\\\ \\end{matrix}\\ \\text{Mg}\\left( \\text{OH} \\right)\\text{Cl}+\\text{N}{{\\text{H}}_{3}}\\uparrow +{{\\text{H}}_{\\text{2}}}\\text{O}$ ; 做安全瓶
"]]装置$\rm A$制备氨气,发生反应的化学方程式为$\text{Mg}{{\left( \text{OH} \right)}_{2}}+\text{N}{{\text{H}}_{\text{4}}}\text{Cl}\begin{matrix} \underline{\underline{_{\triangle }}} \\ {} \\ \end{matrix}\ \text{Mg}\left( \text{OH} \right)\text{Cl}+\text{N}{{\text{H}}_{3}}\uparrow +{{\text{H}}_{\text{2}}}\text{O}$;装置$\rm D$做安全瓶,防止溶液倒吸入$\rm C$中;
反应结束后装置$\rm C$中的氧化铜完全转化为红色固体,为了探究红色固体的成分,进行了如下实验探究:
| 实验操作 | 实验现象 | 实验结论 |
| 取$\rm 10.4$ $\rm g$红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①红色固体为 |
| 若溶液变蓝 | ②红色固体中肯定含有 ,可能含有 | |
| 取上述反应后的混合物过滤、洗涤、干燥、称重,得固体$\rm 6.4$ $\rm g$ | $\rm —$ | ③红色固体的成分及其物质的量为 |
铜 ; 氧化亚铜 ; 铜 ; $\\rm 0.05$ $\\rm mol$ $\\rm Cu$、$\\rm 0.05$ $\\rm mol$ $\\rm Cu_{2}O$
"]]有红色的铜生成,现象为:$\rm A$ 中黑色粉末变为红色,同时有水生成,$\rm D$ 中白色固体变为蓝色;①$\rm Cu$,因为$\rm Cu$在常温下不与稀硫酸反应;②有$\rm CuSO_{4}$生成,溶液变蓝,则红色固体中肯定含有$\rm Cu_{2}O$,不能确定是否含有$\rm Cu$;③所得固体为$\rm Cu$,物质的量为$\rm 0.1$ $\rm mol$;每摩尔$\rm Cu_{2}O$与酸反应前后质量损失为$\rm 80$ $\rm g$,反应前后质量损失为$\rm 4$ $\rm g$,则$\rm 0.05$ $\rm mol$ $\rm Cu_{2}O$参与反应,则生成$\rm Cu$的量为$\rm 0.05$ $\rm mol$,所以原固体中$\rm Cu_{2}O$与$\rm Cu$的物质的量均为$\rm 0.05$ $\rm mol$;
实验二:探究氨的氧化性,实验装置如图$\rm 2$所示。
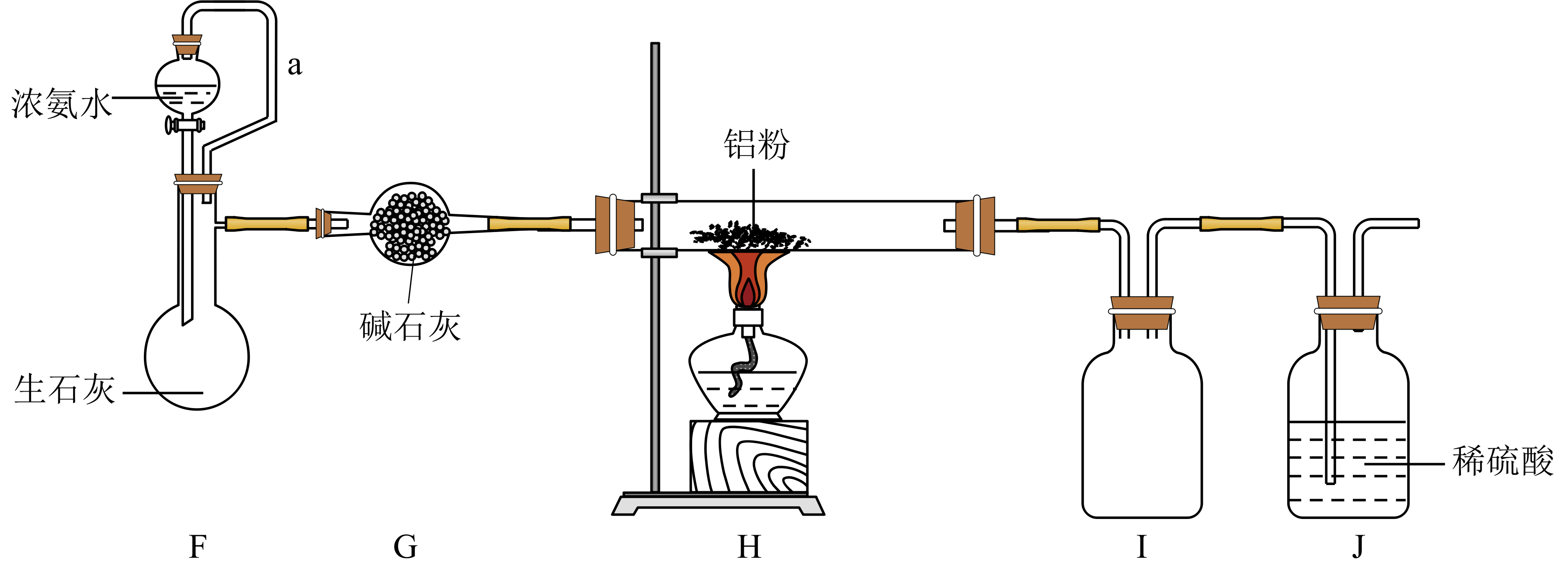
已知:$\rm ($ⅲ$\rm )$铝可以与氨反应: $\text{2Al}+2\text{N}{{\text{H}}_{\text{3}}}\begin{matrix} \underline{\underline{_{\triangle }}} \\ {} \\ \end{matrix}\ 2\text{AlN}+3{{\text{H}}_{\text{2}}}$;
$\rm ($ⅳ$\rm )$氮化铝性质稳定,基本不与水、酸反应,在加热时溶于浓碱可产生氨。
按图$\rm 2$所示连接好装置,检查装置气密性;在蒸馏烧瓶中加入生石灰,分液漏斗中加入浓氨水,装置$\rm G$中盛装碱石灰,装置$\rm H$中加入铝粉,打开装置$\rm F$处分液漏斗活塞,待装置中空气排尽后再点燃装置$\rm H$处酒精灯。
用平衡移动原理解释装置$\rm F$中产生氨的原因: 。
生石灰与水反应放热,降低了氨的溶解度,使一水合氨分解,生石灰与水反应将溶剂消耗,使平衡$\\text{N}{{\\text{H}}_{3}}+{{\\text{H}}_{\\text{2}}}\\text{O}\\rightleftharpoons \\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{\\text{2}}}\\text{O}$向左移动,有利于氨逸出
"]]生石灰与水反应放热,降低了氨的溶解度,使一水合氨分解,生石灰与水反应将溶剂消耗,使平衡$\text{N}{{\text{H}}_{3}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{\text{2}}}\text{O}$向左移动,有利于氨逸出;
装置$\rm H$处反应进行完全的实验现象为 。
装置$\\rm J$中几乎没有气泡冒出
"]]装置$\rm H$处反应进行完全不再有氢气放出,实验现象为装置$\rm J$中几乎没有气泡冒出;
为了得到纯净的氮化铝,可将装置$\rm H$中固体冷却后转移至烧杯中,加入 溶解、 $\rm ($填操作名称$\rm )$、洗涤、干燥即可。
稀盐酸$\\rm ($或稀硫酸等其他合理答案$\\rm )$ ; 过滤
"]]为了得到纯净的氮化铝,可将装置$\rm H$中固体冷却后转移至烧杯中,加入稀盐酸或稀硫酸溶解、过滤、洗涤、干燥即可;
写出氮化铝与浓氢氧化钠溶液共热反应的离子方程式: 。
$\\text{AlN}+\\text{O}{{\\text{H}}^{-}}+{{\\text{H}}_{\\text{2}}}\\text{O}\\begin{matrix} \\underline{\\underline{_{\\triangle }}} \\\\ {} \\\\ \\end{matrix}\\ \\text{AlO}_{\\text{2}}^{-}+\\text{N}{{\\text{H}}_{3}}\\uparrow $
"]]氮化铝与浓氢氧化钠溶液共热反应生成氨气,离子方程式为$\text{AlN}+\text{O}{{\text{H}}^{-}}+{{\text{H}}_{\text{2}}}\text{O}\begin{matrix} \underline{\underline{_{\triangle }}} \\ {} \\ \end{matrix}\ \text{AlO}_{\text{2}}^{-}+\text{N}{{\text{H}}_{3}}\uparrow $。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
