高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
三氯化氧磷$\left( \text{POC}{{\text{l}}_{\text{3}}} \right)$是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。一研究小组在实验室模拟反应:$\text{PC}{{\text{l}}_{3}}+\text{S}{{\text{O}}_{2}}+\text{C}{{\text{l}}_{2}}\begin{matrix} \underline{\underline{60-65\ \rm ^\circ\rm C}} \\ {} \\ \end{matrix}\text{POC}{{\text{l}}_{3}}+\text{SOC}{{\text{l}}_{2}}$,制备$ \text{POC}{{\text{l}}_{\text{3}}}$并测定产品含量。
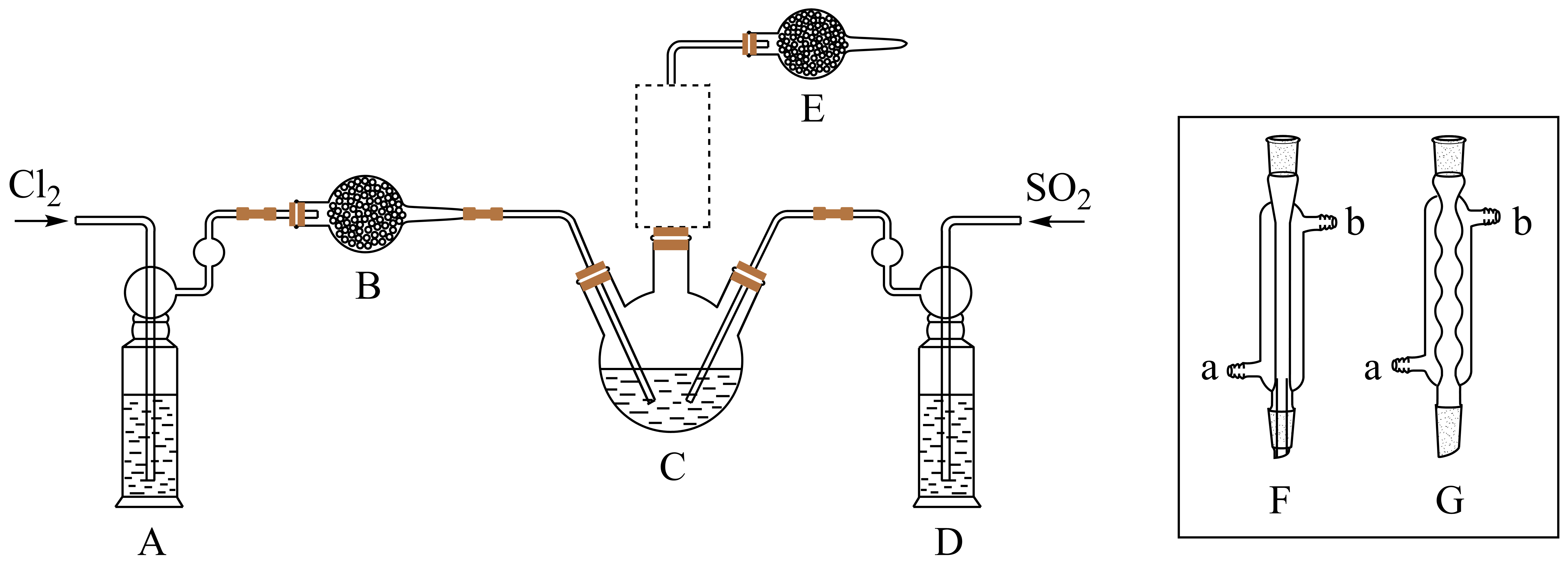
资料卡片:
| 物质 | 熔点$\rm /^\circ\rm C$ | 沸点$\rm /^\circ\rm C$ | 相对分子质量 | 其他 |
| ${\mathrm{PCl}_{3}}$ | $-93.6$ | $\rm 76.1$ | $\rm 137.5$ | 遇水剧烈水解,易与${{\text{O}}_{2}}$反应 |
| $ \text{POC}{{\text{l}}_{\text{3}}}$ | $\rm 1.25$ | $\rm 105.8$ | $\rm 153.5$ | 遇水剧烈水解,放热,能溶于${\mathrm{PCl}_{3}}$ |
| $\text{SOC}{{\text{l}}_{2}}$ | $-105$ | $\rm 78.8$ | $\rm 119$ | 遇水剧烈水解,受热易分解 |
仪器$\rm E$的名称是 ,仪器$\rm A$中的试剂是 。
$\\rm ($球形$\\rm )$干燥管 ;饱和$\\text{NaCl}$溶液
"]]仪器$\rm E$的名称是$\rm ($球形$\rm )$干燥管;由分析可知,装置$\rm A$中盛有饱和食盐水,除去氯气中混有的氯化氢;
实验室制备$\text{C}{{\text{l}}_{2}}$的离子方程式为 。
$\\text{Mn}{{\\text{O}}_{2}}+4{{\\text{H}}^{+}}+2\\text{C}{{\\text{l}}^{-}}\\begin{matrix} \\underline{\\underline{加热 }} \\\\ {} \\\\ \\end{matrix}\\text{M}{{\\text{n}}^{2+}}+\\text{C}{{\\text{l}}_{2}}\\uparrow +2{{\\text{H}}_{2}}\\text{O}$
"]]实验室利用二氧化锰与浓盐酸反应制备氯气,反应生成氯化锰、氯气和水,反应的离子方程式是:$\text{Mn}{{\text{O}}_{2}}+4{{\text{H}}^{+}}+2\text{C}{{\text{l}}^{-}}\begin{matrix} \underline{\underline{加热 }} \\ {} \\ \end{matrix}\text{M}{{\text{n}}^{2+}}+\text{C}{{\text{l}}_{2}}\uparrow +2{{\text{H}}_{2}}\text{O}$;
反应装置图的虚框中未画出的仪器最好选择 $\rm ($填“$\rm F$”或“$\rm G$”$\rm )$。
$\\rm G$
"]]反应装置图的方框中未画出的仪器的主要作用是冷凝、回流,为增强冷凝效果不能选用直形冷凝管,应选择球形冷凝管,故选:$\rm G$;
该反应一般控制在$60\sim65$$\rm ^\circ\rm C$的范围内进行,其原因是 ,因此装置$\rm C$最好选择的加热方式是 。
温度太低,反应速率太慢;温度太高,$\\text{PC}{{\\text{l}}_{\\text{3}}}$等物质会挥发$\\rm (\\text{S}{{\\text{O}}_{\\text{2}}}\\text{C}{{\\text{l}}_{\\text{2}}}$的溶解度降低$\\rm )$利用率降低 ;水浴加热
"]]因若温度太低,反应速率太慢,若温度太高,$\rm PCl_{3}$等物质受热挥发,降低三氯化氧磷的产率,所以实验时用水浴加热三颈烧瓶,控制反应温度在$\rm 60\sim 65\;\rm ^\circ\rm C$;
上述过程制得$ \text{POC}{{\text{l}}_{\text{3}}}$粗品经分离提纯去除${\mathrm{PCl}_{3}}$后,进行如下操作,测定此时$ \text{POC}{{\text{l}}_{\text{3}}}$的含量:准确称取$\text{2}{.000\;\rm g}$样品在水解瓶中摇动至完全水解并稀释至$\text{100\;\rm mL}$,取$\text{10}{.00\;\rm mL}$于锥形瓶中,加$0.2000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$的$\text{AgN}{{\text{O}}_{3}}$溶液$20.00\;\rm \text{mL}\left( \text{A}{{\text{g}}^{+}}+\text{C}{{\text{l}}^{-}}=\text{AgCl}\downarrow \right)$,再加少量硝基苯,用力振荡,使沉淀被有机物覆盖。加入$\text{N}{{\text{H}}_{4}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}$作指示剂,用$0.1000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\ \text{KSCN}$标准溶液滴定过量的$\text{AgN}{{\text{O}}_{3}}$至终点$\left( \text{A}{{\text{g}}^{+}}+\text{SC}{{\text{N}}^{-}}=\text{AgSCN}\downarrow \right)$,做平行实验,平均消耗$\text{KSCN}$标准溶液$10.00\;\rm \text{mL}$。
已知:${{{K}}_{\text{sp}}}(\text{AgCl})=3.2\times {{10}^{-10}},{{{K}}_{\text{sp}}}(\text{AgSCN})=2\times {{10}^{-12}}$。
①$\text{POC}{{\text{l}}_{\text{3}}}$水解的化学方程式为 。
②判断滴定终点的现象为 。
③$\text{POC}{{\text{l}}_{\text{3}}}$的纯度为 $\rm \%($保留四位有效数字$\rm )$。
④实验中,若不加硝基苯,测定$\text{POC}{{\text{l}}_{\text{3}}}$的纯度将 $\rm ($填“偏大”“偏小”或“无影响”$\rm )$。
$\\text{POC}{{\\text{l}}_{3}}+3{{\\text{H}}_{2}}\\text{O}={{\\text{H}}_{3}}\\text{P}{{\\text{O}}_{4}}+3\\text{HCl}\\uparrow $ ;$\\rm ($加入最后半滴标准液$\\rm )$,溶液恰好呈$\\rm ($血$\\rm )$红色,且半分钟溶液红色不褪去; $\\rm 76.75$ ;偏小
"]]①$\rm POC{{l}_{3}}$水解可生成两种酸,分析可知应为磷酸和盐酸,反应的化学方程式为$\rm POC{{l}_{3}}+3{{\text{H}}_{2}}\text{O}={{\text{H}}_{3}}P{{O}_{4}}+3HCl\uparrow $;
②达到滴定终点时,$\rm KSCN$有剩余,$\rm F{{e}^{3+}}$遇$\rm SC{{N}^{-}}$生成$\rm Fe{{\left( SCN \right)}_{3}}$,溶液变为红色,现象是滴入最后半滴$\rm KSCN$溶液,溶液恰好呈$\rm ($血$\rm )$红色,且半分钟内不褪色;
③由题意可知,$\rm \text{AgN}{{\text{O}}_{3}}$溶液与$\rm \text{POC}{{\text{l}}_{\text{3}}}$中的氯离子反应生成氯化银,过量的$\rm \text{AgN}{{\text{O}}_{3}}$溶液被$\rm \text{KSCN}$标准溶液滴定,则$\rm KSCN$消耗$\rm AgN{{O}_{3}}$的物质的量为$\rm 0.1000\;\rm mol\cdot {{\text{L}}^{-1}}\times 0.01\ \text{L}=0.001\;\rm mol$,$\rm POC{{l}_{3}}$水解出的氯离子和$\rm KSCN$共消耗$\rm 0.2000\;\rm mol\cdot {{\text{L}}^{-1}}$的$\rm AgN{{O}_{3}}$溶液$\rm 20.00\;\rm mL$,则$\rm POC{{l}_{3}}$水解出的氯离子的物质的量为$\rm 0.2000\;\rm mol\cdot {{\text{L}}^{-1}}\times 0.02\ \text{L}-0.001\;\rm mol=0.003\;\rm mol$,$\rm POC{{l}_{3}}$的物质的量为$\rm 0.001\;\rm mol$ ,所以$\rm POC{{l}_{3}}$的质量百分含量为$\rm \dfrac{0.001\;\rm mol\times 153.5\text{g}/mol\times \dfrac{100\;\rm mL}{10\;\rm mL}}{2.000\text{g}}\times 100\%=76.75\%$。
④$K_{\rm sp}{(\rm AgCl)}\gt K_\rm {sp}(AgSCN)$,所以若无硝基苯覆盖沉淀表面,滴定剩余$\rm Ag^{+}$时,会有部分$\rm AgCl$沉淀转化为$\rm AgSCN$,导致消耗的$\rm KSCN$标准液偏大,即计算出的剩余$\rm Ag^{+}$偏多,结合③可知测定$\rm POCl_{3}$的质量分数将偏小。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
