高中 | 盖斯定律 题目答案及解析
稿件来源:高途
高中 | 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
石油加氢精制和天然气净化等过程产生有毒的${{\text{H}}_{2}}\text{S}$,直接排放会污染空气。
工业上用克劳斯工艺处理含${{\text{H}}_{2}}\text{S}$的尾气获得硫黄,流程如图:
![]()
①反应炉中的反应:$2{{\text{H}}_{2}}\text{S}\left( \text{g} \right)+3{{\text{O}}_{2}}\left( \text{g} \right)=2\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta H=-1035.6\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
催化转化器中的反应:$2{{\text{H}}_{2}}\text{S}\left( \text{g} \right)+\text{S}{{\text{O}}_{2}}\left( \text{g} \right)=3\text{S}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta H=-92.8\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
克劳斯工艺中获得气态硫黄的总反应的热化学方程式: 。
②为使${{\text{H}}_{2}}\text{S}$全部转化为$\rm S$,理论上应控制反应炉中${{\text{H}}_{2}}\text{S}$的转化率为 。
$2{{\\text{H}}_{2}}\\text{S}\\left( \\text{g} \\right)+{{\\text{O}}_{2}}\\left( \\text{g} \\right)=2\\text{S}\\left( \\text{g} \\right)+2{{\\text{H}}_{2}}\\text{O}\\left( \\text{g} \\right)\\quad \\Delta H=-407.1\\,\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$ ; $\\dfrac{1}{3}$或$33.3\\%$
"]]①反应Ⅰ:$2{{\text{H}}_{2}}\text{S}\left( \text{g} \right)+3{{\text{O}}_{2}}\left( \text{g} \right)=2\text{S}{{\text{O}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta H=-1035.6\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;反应Ⅱ:$2{{\text{H}}_{2}}\text{S}\left( \text{g} \right)+\text{S}{{\text{O}}_{2}}\left( \text{g} \right)=3\text{S}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta H=-92.8\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,根据盖斯定律Ⅰ$\times \dfrac{1}{3}+$Ⅱ$\times \dfrac{2}{3}$得 $2{{\text{H}}_{2}}\text{S}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2\text{S}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta H=-1035.6\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\times \dfrac{1}{3}-92.8\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\times \dfrac{2}{3}=-407.1\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
②为了提高${{\text{H}}_{2}}\text{S}$转化为$\rm S$的比例,催化转化器中${{\text{H}}_{2}}\text{S}\left( \text{g} \right)$、$\text{S}{{\text{O}}_{2}}\left( \text{g} \right)$应恰好完全反应,假设催化转化器中参加反应的${{\text{H}}_{2}}\text{S}\left( \text{g} \right)$的物质的量为$\rm 2$ $\rm mol$,$\text{S}{{\text{O}}_{2}}$的物质的量是$\rm 1$ $\rm mol$,即反应炉中需要生成$1\,\text{mol}\,\text{S}{{\text{O}}_{2}}$,反应炉中参加反应的${{\text{H}}_{2}}\text{S}$的物质的量为$\rm 1$ $\rm mol$,所以理论上应控制反应炉中${{\text{H}}_{2}}\text{S}$的转化率为$\dfrac{1}{3}$或$33.3\%$;
科研工作者利用微波法处理尾气中的${{\text{H}}_{2}}\text{S}$并回收${{\text{H}}_{2}}$和$\rm S$,反应为:${{\text{H}}_{2}}\text{S}\xrightarrow{\text{一定条件}}{{\text{H}}_{2}}+\text{S}$,一定条件下,${{\text{H}}_{2}}\text{S}$的转化率随温度变化的曲线如图。
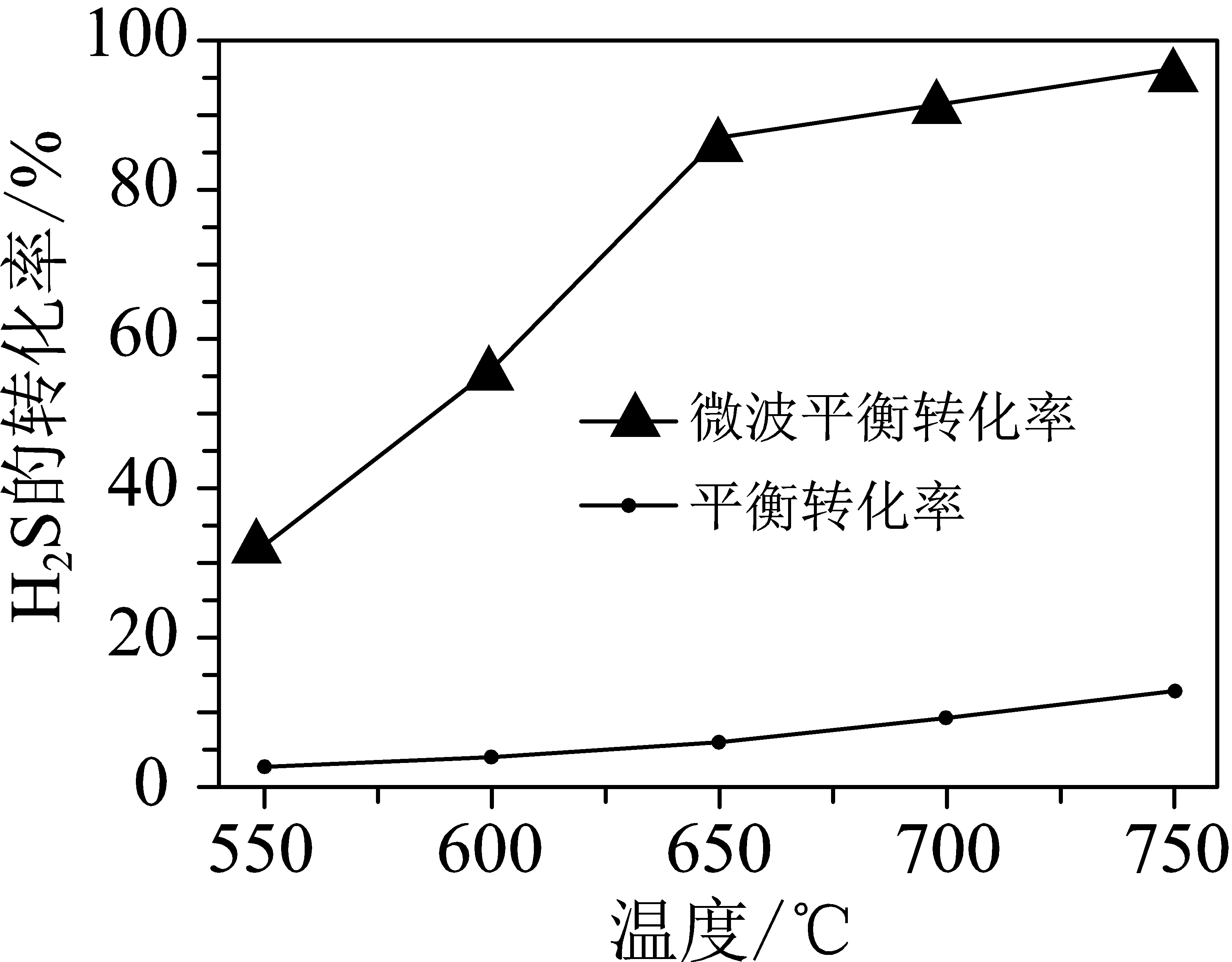
①${{\text{H}}_{2}}\text{S}$分解生成${{\text{H}}_{2}}$和$\rm S$的反应为 反应$($填“吸热”或“放热”$)$。
②微波的作用是 。
吸热 ; 微波使${{\\text{H}}_{2}}\\text{S}\\rightleftharpoons {{\\text{H}}_{2}}+\\text{S}$的化学平衡向正反应方向移动,提高平衡转化率
"]]①根据图示,随温度升高,${{\text{H}}_{2}}\text{S}$的平衡转化率增大,说明升高温度,平衡正向移动,正反应为吸热反应;
②根据图示,相同温度下,利用微波法处理尾气${{\text{H}}_{2}}\text{S}$的平衡转化率大,所以微波的作用是使${{\text{H}}_{2}}\text{S}\rightleftharpoons {{\text{H}}_{2}}+\text{S}$的化学平衡向正反应方向移动,提高平衡转化率;
某科研小组将微电池技术用于去除天然气中的${{\text{H}}_{2}}\text{S}$,装置示意图,主要反应:$2\text{Fe}+2{{\text{H}}_{2}}\text{S}+{{\text{O}}_{2}}=2\text{FeS}+2{{\text{H}}_{2}}\text{O}(\text{FeS}$难溶于水$)$,室温时,$\text{pH}=7$的条件下,研究反应时间对${{\text{H}}_{2}}\text{S}$的去除率的影响。

①装置中微电池负极的电极反应式: 。
②一段时间后,单位时间内${{\text{H}}_{2}}\text{S}$的去除率降低,可能的原因是 $($写两条$)$。
$\\text{Fe}-2{{\\text{e}}^{-}}+{{\\text{H}}_{2}}\\text{S}=\\text{FeS}+2{{\\text{H}}^{+}}$ ; 生成的$\\rm FeS$附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢;铁的量因消耗而减少,形成微电池的数量减少,化学反应速率减慢
"]]①根据总反应$2\text{Fe}+2{{\text{H}}_{2}}\text{S}+{{\text{O}}_{2}}=2\text{FeS}+2{{\text{H}}_{2}}\text{O}$,$\rm Fe$发生氧化反应,$\rm Fe$是原电池负极,负极反应式是$\text{Fe}-2{{\text{e}}^{-}}+{{\text{H}}_{2}}\text{S}=\text{FeS}+2{{\text{H}}^{+}}$;
②负极生成的$\rm FeS$附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢;铁的量因消耗而减少,形成微电池的数量减少,化学反应速率减慢,所以一段时间后,单位时间内${{\text{H}}_{2}}\text{S}$的去除率降低;
${{\text{K}}_{4}}[\text{Fe}\left( \text{CN}{{)}_{6}} \right]$溶液去除${{\text{H}}_{2}}\text{S}$
去除示意图如图,电解一段时间后通入${{\text{H}}_{2}}\text{S}$,生成的铁的化合物${{\text{K}}_{3}}[\text{Fe}\left( \text{CN}{{)}_{6}} \right]$将${{\text{H}}_{2}}\text{S}$转化为$\rm S$,自身还原为${{\text{K}}_{4}}[\text{Fe}\left( \text{CN}{{)}_{6}} \right]$,且$\text{KHC}{{\text{O}}_{3}}$的浓度恢复如初持续保持不变。
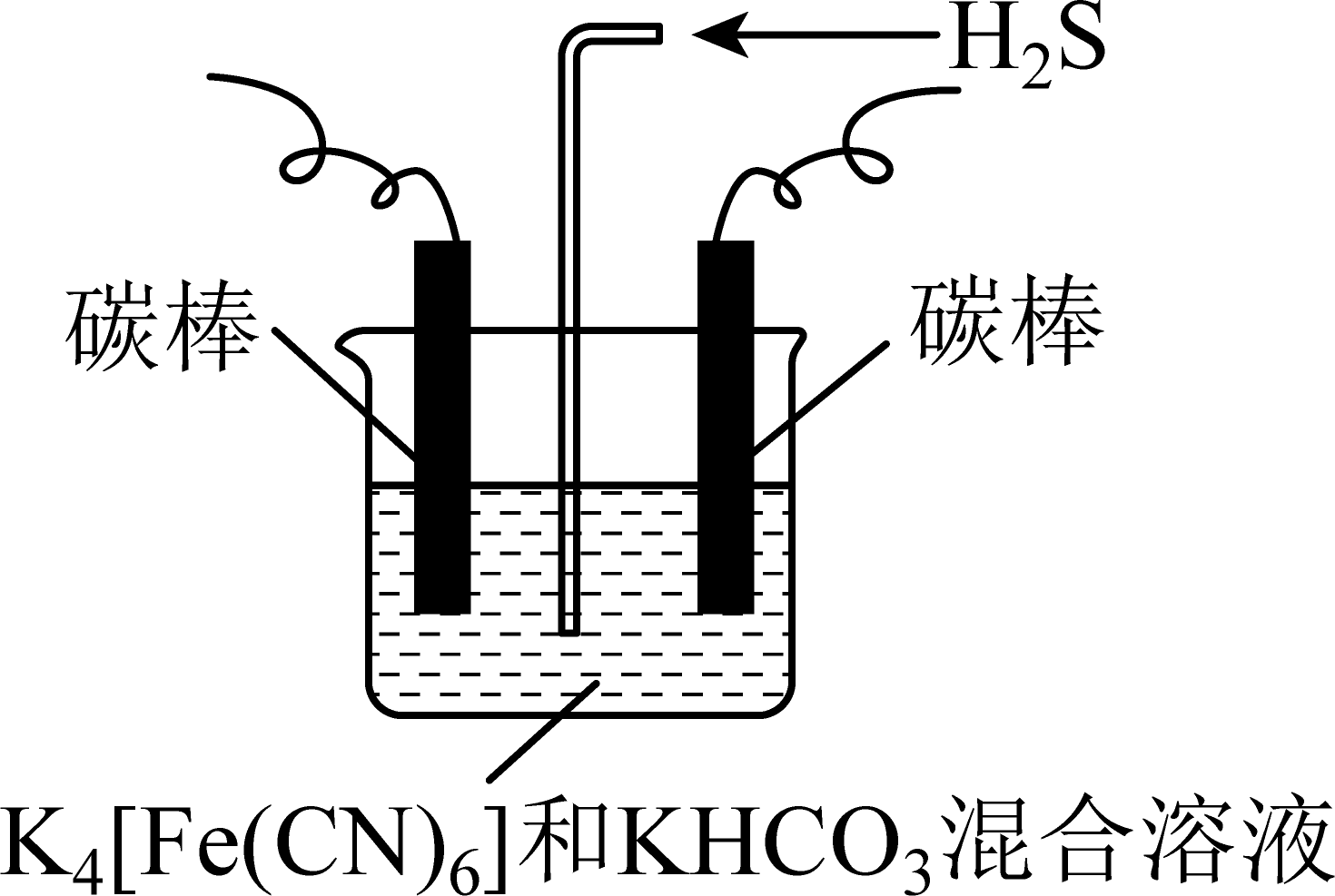
①电解时,阴极的电极反应式为 。
②通入${{\text{H}}_{2}}\text{S}$时发生反应为 。
③上述过程理论上最终想实现的总反应为 。
$2\\text{HCO}_{3}^{-}+2{{\\text{e}}^{-}}={{\\text{H}}_{2}}+2\\text{CO}_{3}^{2-}$ ; $2{{[\\text{Fe}{{(\\text{CN})}_{6}}]}^{3-}}+2\\text{CO}_{3}^{2-}+{{\\text{H}}_{2}}\\text{S}=2{{[\\text{Fe}{{(\\text{CN})}_{6}}]}^{4-}}+2\\text{HCO}_{3}^{-}+\\text{S}$ ; ${{\\text{H}}_{2}}\\text{S}=\\text{S}+{{\\text{H}}_{2}}$
"]]①电解时,${{\text{H}}_{2}}\text{O}$在阴极得到电子生成${{\text{H}}_{2}}$和$\text{O}{{\text{H}}^{-}}$,$\text{O}{{\text{H}}^{-}}$和$\text{HCO}_{3}^{-}$发生反应生成$\text{CO}_{3}^{2-}$,根据得失电子守恒和电荷守恒配平阴极电极方程式为:$2\text{HCO}_{3}^{-}+2{{\text{e}}^{-}}={{\text{H}}_{2}}+2\text{CO}_{3}^{2-}$;
②${{\text{K}}_{3}}[\text{Fe}\left( \text{CN}{{)}_{6}} \right]$将${{\text{H}}_{2}}\text{S}$转化为$\rm S$和 ${{\text{K}}_{4}}[\text{Fe}\left( \text{CN}{{)}_{6}} \right]$,$\rm Fe$ 元素由$+3$降低到$+2$,$\rm S$元素由$-2$升高到$\rm 0$价,由电子、电荷、原子守恒可知离子方程式为:$2{{[\text{Fe}{{(\text{CN})}_{6}}]}^{3-}}+2\text{CO}_{3}^{2-}+{{\text{H}}_{2}}\text{S}=2{{[\text{Fe}{{(\text{CN})}_{6}}]}^{4-}}+2\text{HCO}_{3}^{-}+\text{S}$;
③电解时阳极发生失电子的氧化反应,将${{[\text{Fe}{{(\text{CN})}_{6}}]}^{4-}}$转化为${{[\text{Fe}{{(\text{CN})}_{6}}]}^{3-}}$,则电极反应式为${{[\text{Fe}{{(\text{CN})}_{6}}]}^{4-}}{{\text{e}}^{-}}={{[\text{Fe}{{(\text{CN})}_{6}}]}^{3-}}$,则上述过程理论上最终想实现将${{\text{H}}_{2}}\text{S}$转化为${{\text{H}}_{2}}$和$\rm S$,化学方程式为:${{\text{H}}_{2}}\text{S}=\text{S}+{{\text{H}}_{2}}$。
高中 | 盖斯定律题目答案及解析(完整版)
