高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。回答下列问题:
$\rm I$.$\text{C}{{\text{O}}_{2}}$和$\text{N}{{\text{H}}_{3}}$合成尿素
$2\text{N}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{CO}{{(\text{N}{{\text{H}}_{2}})}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{g})\qquad\Delta {H}=-87\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$分两步完成,
第一步:$2\text{N}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}(\text{s})$
第二步:$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}(\text{s})\rightleftharpoons \text{CO}{{(\text{N}{{\text{H}}_{2}})}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{g})$,其能量变化如图所示。
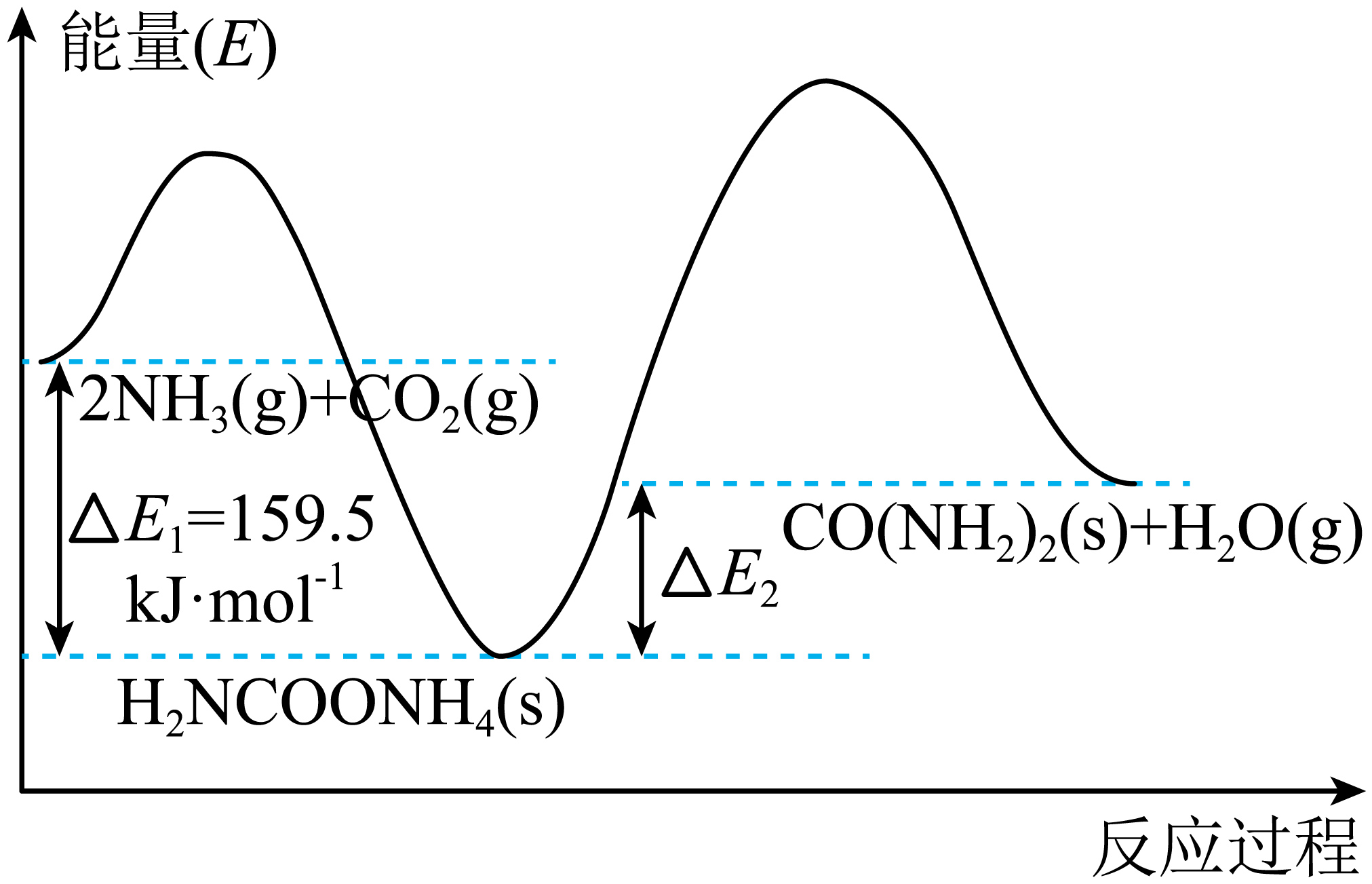
反应速率较快的是 反应$\rm ($填“第一步”或“第二步”$\rm )$。
第一步
"]]由图中可知,第二步的活化能比第一步大,活化能越大的反应速率越慢,则反应速率较快的是第一步。
$\Delta {{ {E}}_{2}}=$ $ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
$\\rm 72.5$
"]]根据反应$2\text{N}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{CO}{{(\text{N}{{\text{H}}_{2}})}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{g})\qquad\Delta {H}=-87\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,根据盖斯定律,需要对方程式进行合并计算,第一步反应是:$2\text{N}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}(\text{s})$;第二步反应是:$\text{N}{{\text{H}}_{2}}\text{COON}{{\text{H}}_{4}}(\text{s})\rightleftharpoons \text{CO}{{(\text{N}{{\text{H}}_{2}})}_{2}}(\text{s})+{{\text{H}}_{2}}\text{O}(\text{g})$。由盖斯定律可知:总反应$\rm =$第一步$\rm -$第二步,得到$\Delta {{ {E}}_{2}}=-87-\left( -159.5 \right)=72.5\;\rm kJ/mol$。
已知尿素熔点:$\rm 132.7\;\rm ^\circ\rm C$,丙酮熔点:$-94.9\;^\circ \rm C$,尿素的熔点高于丙酮的原因是 。
尿素分子间存在氢键
"]]尿素分子中含有两个氨基,其氮原子和羰基的氧原子均可参与形成分子间氢键。而丙酮分子中仅含羰基,且其氧原子无法与其他丙酮分子形成氢键,仅依赖较弱的范德华力。所以尿素的熔点高于丙酮的原因是:尿素分子间存在氢键。
$\rm I$$\rm I$.$\text{C}{{\text{O}}_{2}}$和$\text{C}{{\text{H}}_{4}}$催化重整制备合成气
在密闭容器中通入$\rm 0.2\;\rm mol\text{ C}{{\text{H}}_{4}}$和$\rm 0.2\;\rm mol\text{ C}{{\text{O}}_{2}}$,在一定条件下发生反应:$\text{C}{{\text{O}}_{2}}(\text{g})+\text{C}{{\text{H}}_{4}}(\text{g})\rightleftharpoons 2\text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g})$。$\text{C}{{\text{H}}_{4}}$的平衡转化率随温度、压强的变化如图所示。
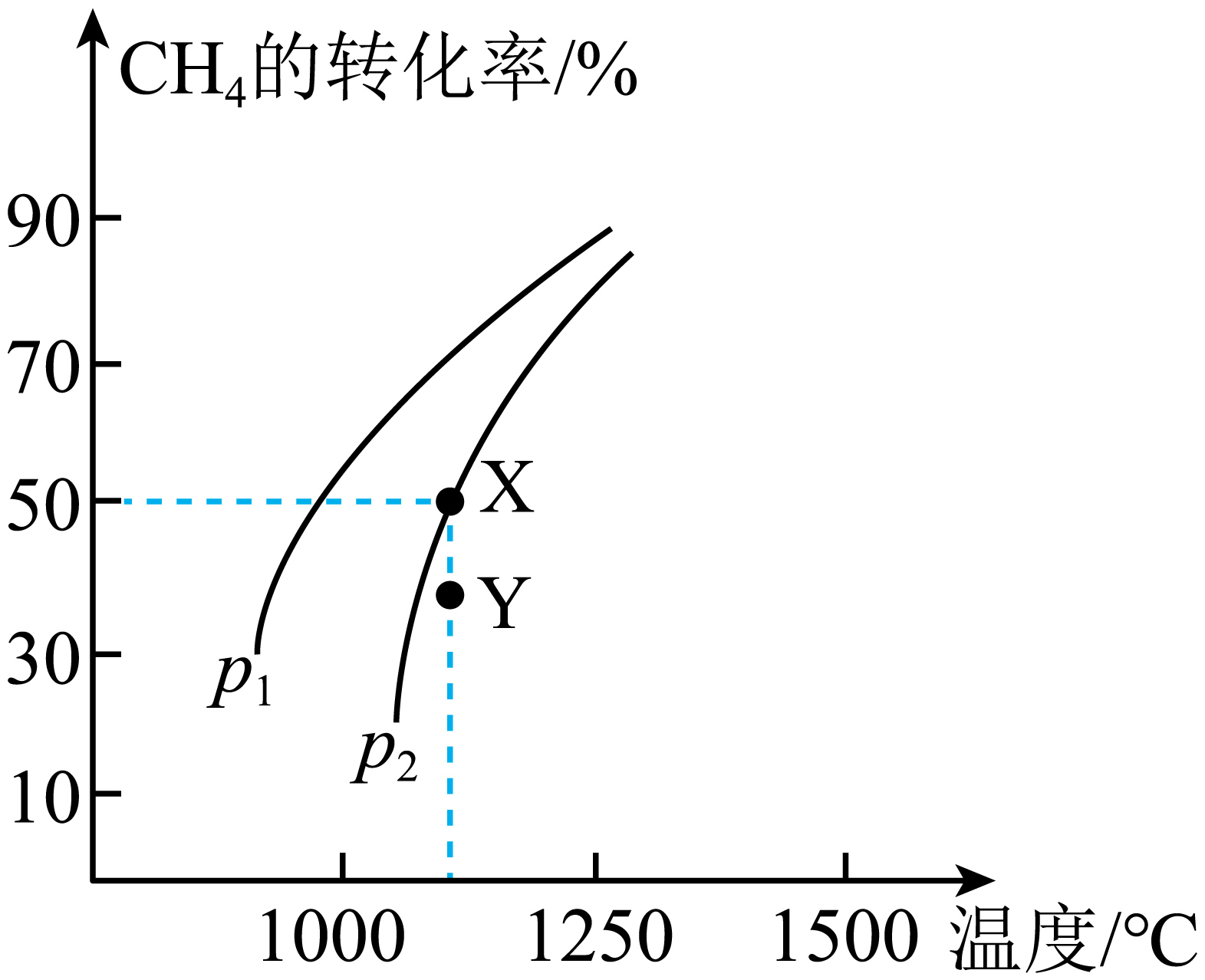
若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是 $\rm ($填序号$\rm )$。
$\rm a.$反应速率:${{ {v}}_正{}}(\text{C}{{\text{O}}_{2}})=2{{ {v}}_逆{}}({{\text{H}}_{2}})$
$\rm b.$同时断裂$\rm 2\;\rm mol\;\rm C-H$键和$\rm 1\;\rm mol\;\rm H-H$键
$\rm c.$容器中混合气体的密度保持不变
$\rm d.$容器内混合气体的平均摩尔质量保持不变
$\\rm b$、$\\rm d$
"]]$\operatorname{a}$。根据方程式计量系数关系,应该为:$2{{v}_正{}}\left( C{{O}_{2}} \right)={{v}_逆{}}\left( {{\text{H}}_{2}} \right)$才说明达到平衡状态,$\operatorname{a}$错误;
$\operatorname{b}$。断裂$2\;\rm mol\;\rm C-\text{H}$键时生成$1\;\rm mol\;\rm H-\text{H}$键,同时又断裂$1\;\rm mol\;\rm H-\text{H}$键,正反应速率等于逆反应速,反应达到平衡,$\operatorname{b}$正确;
$\operatorname{c}$.在恒温、恒容密闭容器中发生,参加反应的各组分都是气体,混合气体的总质量不变,则密度一直不变,密度不变不能说明反应达到平衡,$\operatorname{c}$错误;
$\operatorname{d}$。参加反应的各组分都是气体,混合气体的总质量不变,而反应的气体的物质的量在发生改变,即混合气体的平均摩尔质量中变化,当反应达到平衡混合气体的平均摩尔质量保持不变,$\operatorname{d}$正确;
故选:$\rm bd$。
由上图可知,压强${{{P}}_{1}}$ ${{{P}}_{2}}\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”,下同$\rm )$;$\rm Y$点速率${{{v}}_正{}}$ ${{{v}}_逆{}}$。
$\\rm \\lt $;$\\rm \\gt $
"]]$\rm {C}{{{O}}_{2}}({g})+{C}{{{H}}_{4}}({g})\rightleftharpoons 2{CO}({g})+2{{{H}}_{2}}({g})$反应正向气体体积增大,增大压强,平衡逆向移动,甲烷的转化率减小,结合图中信息可知,${{{p}}_{1}}\lt {{{p}}_{2}}$;$\operatorname{Y}$点甲烷转化率低于平衡时转化率,反应正向进行,则${{{v}}_正{}}\gt {{{v}}_逆{}}$。
若容器体积$\rm 2\;\rm L$,则$\rm X$点对应温度下的平衡常数$ {K}=$ 。
$\\rm 0.04$
"]]$\operatorname{X}$点甲烷的平衡转化率为$50\%$,消耗$ {n}\left(\rm C{{H}_{4}} \right)=0.2\;\rm mol\times 50\%=0.1\;\rm mol$,列三段式:$\begin{matrix} {} & \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & + & \text{C}{{\text{H}}_{\text{4}}}\left( \text{g} \right) & \rightleftharpoons & \text{2CO}\left( \text{g} \right) & + & \text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right) \\ 开始量\left( \text{mol} \right) & \text{0}\text{.2} & {} & \text{0}\text{.2} & {} & \text{0} & {} & \text{0} \\反应量 \left( \text{mol} \right) & \text{0}\text{.1} & {} & \text{0}\text{.1} & {} & \text{0}\text{.2} & {} & \text{0}\text{.2} \\ 平衡量\left( \text{mol} \right) & \text{0}\text{.1} & {} & \text{0}\text{.1} & {} & \text{0}\text{.2} & {} & \text{0}\text{.2} \\ \end{matrix}$,则平衡常数$ {K}=\dfrac{{{{c}}^{\text{2}}}\left( \text{CO} \right)\cdot {{{c}}^{\text{2}}}\left( {{\text{H}}_{\text{2}}} \right)}{{c}\left( \text{C}{{\text{H}}_{\text{4}}} \right)\cdot {c}\left( \text{C}{{\text{O}}_{\text{2}}} \right)}=\dfrac{{{\left( \dfrac{0.2}{2} \right)}^{2}}\times {{\left( \dfrac{0.2}{2} \right)}^{2}}}{\dfrac{0.1}{2}\times \dfrac{0.1}{2}}=0.04$。
$\rm II$$\rm I$.$\rm \text{C}{{\text{O}}_{2}}$电催化生产燃料
$\rm \text{C}{{\text{O}}_{2}}$通过电催化可生成多种燃料,装置如图所示。
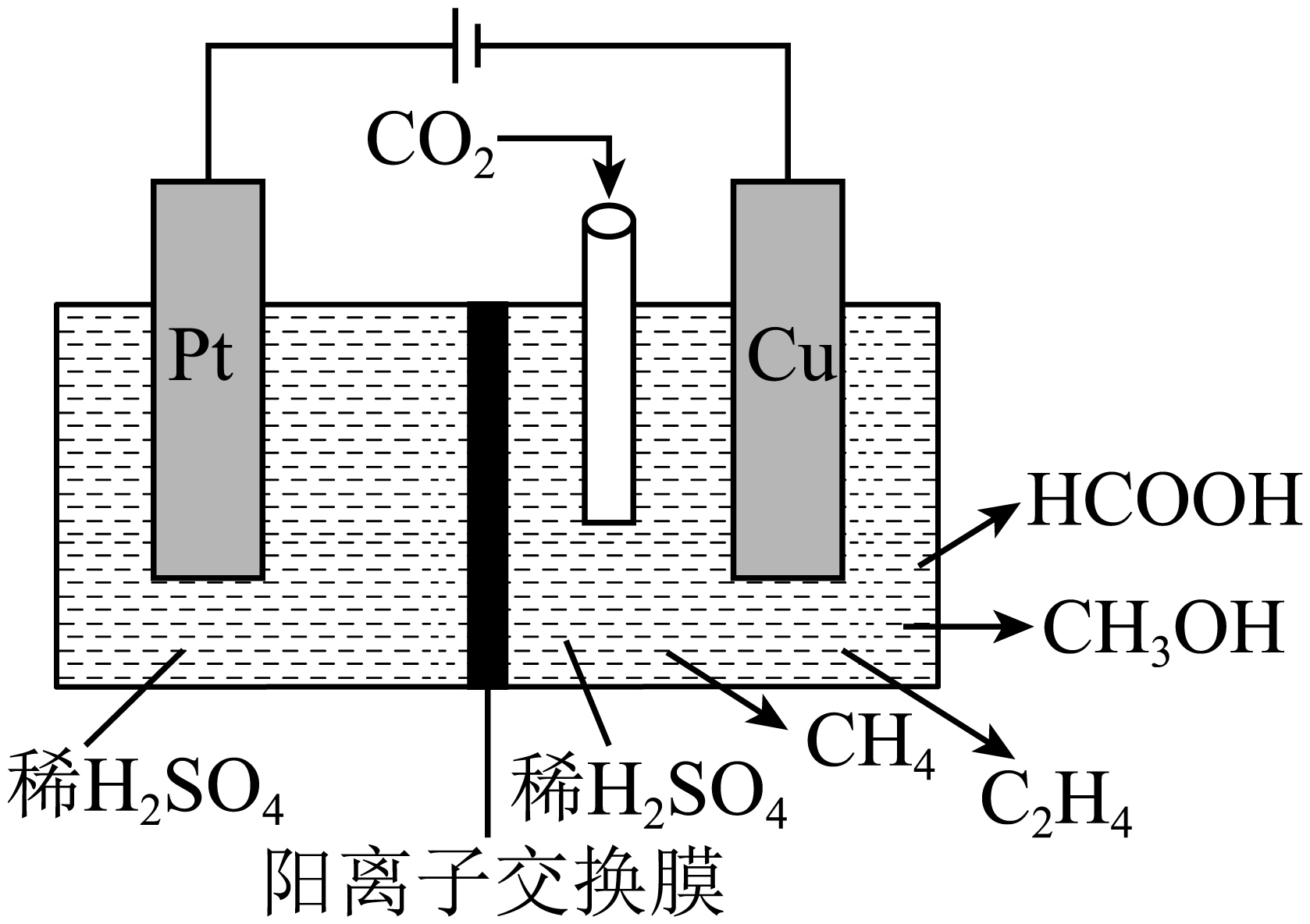
$\rm Cu$电极上产生$\rm HCOOH$的电极反应式为 。
$\\rm \\text{C}{{\\text{O}}_{2}}+2{{\\text{e}}^{-}}+2{{\\text{H}}^{+}}=\\text{HCOOH}$
"]]充电时,阴极反应中$\rm 1\;\rm mol\;\rm C{{O}_{2}}$完全转化为$\rm HCOOH$时有$\rm 2\;\rm mol\;{{e}^{-}}$转移,则铜电极上产生$\rm HCOOH$的电极反应式为$\rm C{{O}_{2}}+2{{\text{H}}^{+}}+2{{\text{e}}^{-}}=HCOOH$。
若$\rm Cu$电极上只生成$\rm 0.15\;\rm mol{{\text{ C}}_{2}}{{\text{H}}_{4}}$和$\rm 0.30\;\rm mol\text{ C}{{\text{H}}_{3}}\text{OH}$,则$\rm Pt$电极上产生的${{\text{O}}_{2}}$在标准状况下的体积为 $\rm L$。
$\\rm 20.16$
"]]如果$\rm Cu$电极上只生成$\rm \text{0} {.15\;\rm mol}{{\text{ C}}_{\text{2}}}{{\text{H}}_{\text{4}}}$和$\rm \text{0} {.30\;\rm mol\;\rm C}{{\text{H}}_{\text{3}}}\text{OH}$,$\rm {{\text{C}}_{2}}{{\text{H}}_{4}}$和$\rm C{{H}_{3}}OH$的碳元素都为$\rm -2$价,则转移的电子数为$\rm 0.15\;\rm mol\times 2\times 6{{\text{e}}^{-}}+0.30\;\rm mol\times 6{{\text{e}}^{-}}=3.6\;\rm mol\;{{e}^{-}}$,根据阳极电极反应:$\rm 2 \mathrm{H}_{2} \mathrm{O}-4 \mathrm{e}^{-}=4 \mathrm{H}^{+}+\mathrm{O}_{2} \uparrow$,则$\rm Pt$电极上产生氧气的物质的量为$\rm 0.9\;\rm mol$,标准状况下的体积为$\rm 0.9\;\rm \text{mol}\times 22.4\text{ L/mol}=20.16\text{ L}$。
高中 | 化学平衡常数题目答案及解析(完整版)
