高中 | 化学反应速率的相关计算 题目答案及解析
稿件来源:高途
高中 | 化学反应速率的相关计算题目答案及解析如下,仅供参考!
必修二
第二章 化学反应与能量
第三节 化学反应的速率和限度
化学反应速率的相关计算
化学工业在碳中和领域起着重要作用,目前对二氧化碳的综合利用有多种途径。
途径一:将工业废气中的二氧化碳转化为甲烷,原理如下:
反应$\rm i$ $\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{{H}}_{1}}=-164.9\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
途径二:二氧化碳和氢气合成甲醇,原理如下:
反应$\rm ii$ $\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{{H}}_{2}}=-49.4\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应$\rm iii$ $\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{{H}}_{3}}=+41.2\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
请回答下列问题:
$\text{C}{{\text{O}}_{2}}$分子为 分子$\rm ($填“极性”或“非极性”$\rm )$,$\text{C}{{\text{O}}_{2}}$分子的空间结构为 。
非极性分子 ;直线形
"]]$\rm CO_{2}$分子的中心原子为$\rm C$,采用$\rm sp$杂化,空间构型为直线形,为非极性分子;
结合反应$\rm i$和以下信息,写出$\text{C}{{\text{H}}_{4}}$燃烧热的热化学方程式 。
已知:${{\text{H}}_{2}}\text{O}\left( \text{g} \right)={{\text{H}}_{2}}\text{O}\left(\rm l \right)\quad \Delta {H}=-44\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;$2{{\text{H}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\quad \Delta{H}=-571.6\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
${\\rm CH_{4}(g)+2O_{2}(g)=CO_{2}(g)+2H_{2}O(l)}\\quad \\Delta H=-890.3\\;\\rm kJ/mol$
"]]反应Ⅳ:${{\text{H}}_{2}}\text{O}\left( \text{g} \right)={{\text{H}}_{2}}\text{O}\left( 1 \right)\quad \Delta {H}=-44\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;,反应Ⅴ:$2{{\text{H}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=2{{\text{H}}_{2}}\text{O}\left( \text{l} \right)\quad \Delta {H}=-571.6\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,$\rm CH_{4}$燃烧热的热化学方程式为${\rm CH_{4}(g)+2O_{2}(g)=CO_{2}(g)+2H_{2}O(l)}\quad \Delta H$,可以由反应Ⅴ$\rm \times 2-$反应ⅰ$\rm -$反应Ⅳ$\rm \times 2$得到,$\Delta H=(-571.6\;\rm kJ/mol)\times 2+164.9\;\rm kJ/mol+44\;\rm kJ/mol\times 2=-890.3\;\rm kJ/mol$;
反应$\rm ii$的$\Delta S$ $\rm 0($选填“$\rm \gt $、$\rm \lt $或$\rm =$”$\rm )$,在 $\rm ($选填“较高”、“较低”或“任意”$\rm )$温度下能自发进行。
$\\rm \\lt $ ;较低
"]]反应ⅱ$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{{H}}_{2}}=-49.4\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,反应ⅱ的$\Delta S\lt 0$,$\Delta H\lt 0$,当$\Delta G=\Delta H-T\Delta S\lt 0$时能自发进行,应当为较低温度条件;
恒温恒容条件下的反应$\rm iii$,下列能判断该反应已经达到平衡状态的$(\quad\ \ \ \ )$。
混合气体密度不变
","反应容器受到的压强不变
","$\\text{C}{{\\text{O}}_{2}}$、${{\\text{H}}_{2}}$、$\\text{CO}$、${{\\text{H}}_{2}}\\text{O}$的分子个数比为${1: 1: 1: 1: 1}$
","断裂$1\\ \\text{mol\\ H}-\\text{H}$键的同时断裂$2\\;\\rm \\text{mol}$的$\\text{O}-\\text{H}$键
"]$\rm A\rm .$恒温恒容条件下,气体的体积和质量均不变,混合气体的密度是个不变的量,不能判断化学平衡状态,故$\rm A$不选;
$\rm B\rm .$反应ⅲ反应前后气体体积不变,恒温恒容条件下,反应的压强一直不变,不能判断达到化学平衡状态,故$\rm B$不选;
$\rm C\rm .$ $\text{C}{{\text{O}}_{2}}$、${{\text{H}}_{2}}$、$\text{CO}$、${{\text{H}}_{2}}\text{O}$的分子个数比为${1: 1: 1: 1: 1}$,但是不能判断其是否会发生变化,不能说明达到平衡,故$\rm C$不选;
$\rm D\rm .$断裂$\rm 1\;\rm mol$ $\rm H-H$键的同时断裂 $\rm 2\;\rm mol$的$\rm O-H$键时正逆反应速率相等,达到化学平衡状态,故$\rm D$选;
一定条件下研究途径一,相同时间内测得甲烷产率与催化剂、温度变化关系如下图所示。则反应$\rm i$最适宜的催化剂和反应温度是 。
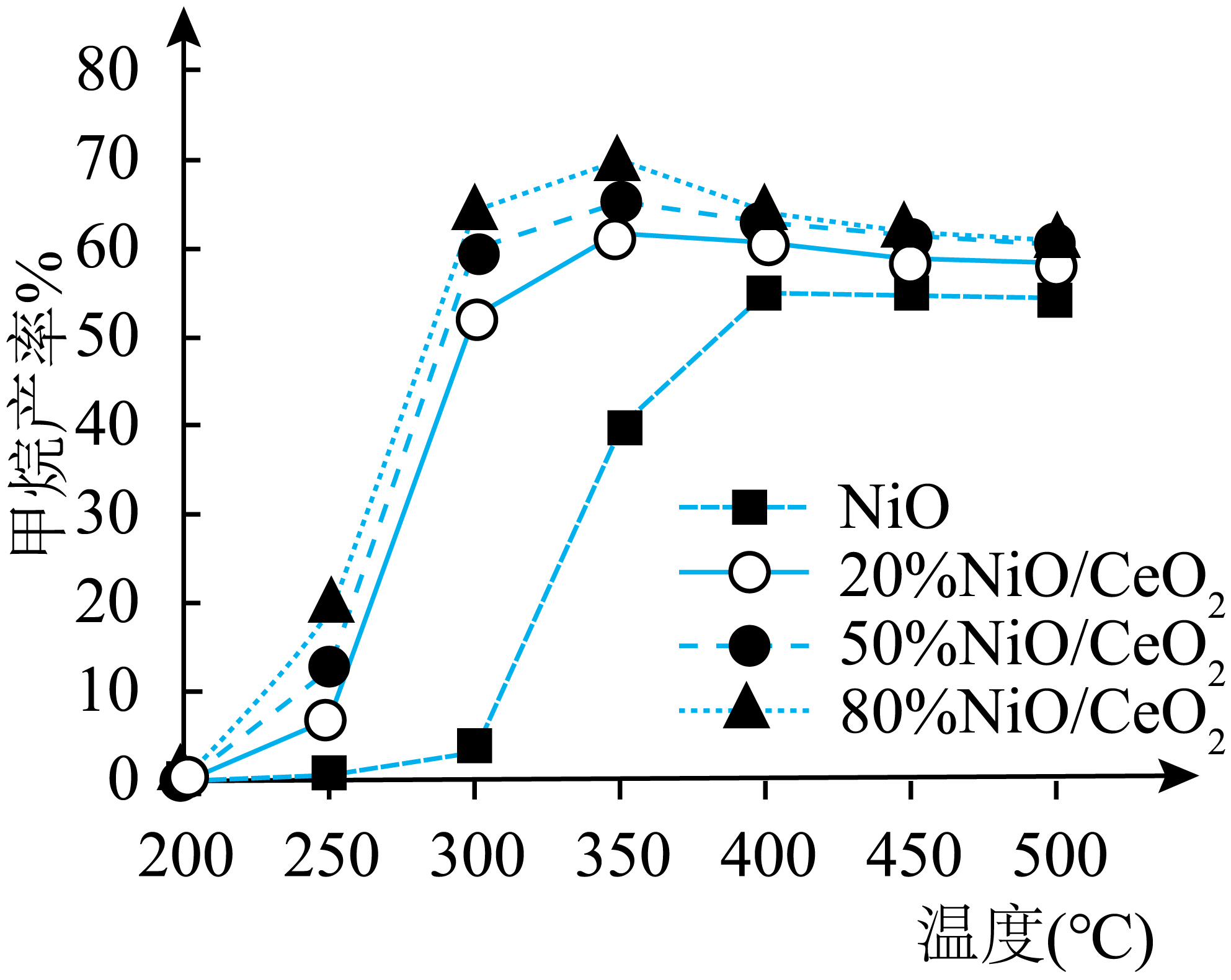
$\\rm 80\\%NiO/CeO_{2}$,$\\rm 350\\;\\rm ^\\circ\\rm C$
"]]甲烷的产率较高的条件下,条件较为适宜,此时催化剂和温温度分别是$\rm 80\%NiO/CeO_{2}$,$\rm 350\;\rm ^\circ\rm C$;
在某密闭容器中通入$\text{C}{{\text{O}}_{2}}$与$\text{C}{{\text{H}}_{4}}$各$3.0\;\rm \text{mol}$,一定条件下发生反应:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+\text{C}{{\text{H}}_{4}}\left( \text{g} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)$,测得$\text{C}{{\text{H}}_{4}}$的平衡转化率与温度及压强的关系如下图所示。则化学反应速率$v\left( \text{a} \right)$ $v\left( \text{b} \right)\rm ($填“$\rm \lt $”“$\rm =$”或“$\rm \gt $”,下同$\rm )$,$K\left( \text{a} \right)$ $K\left( \text{c} \right)$。
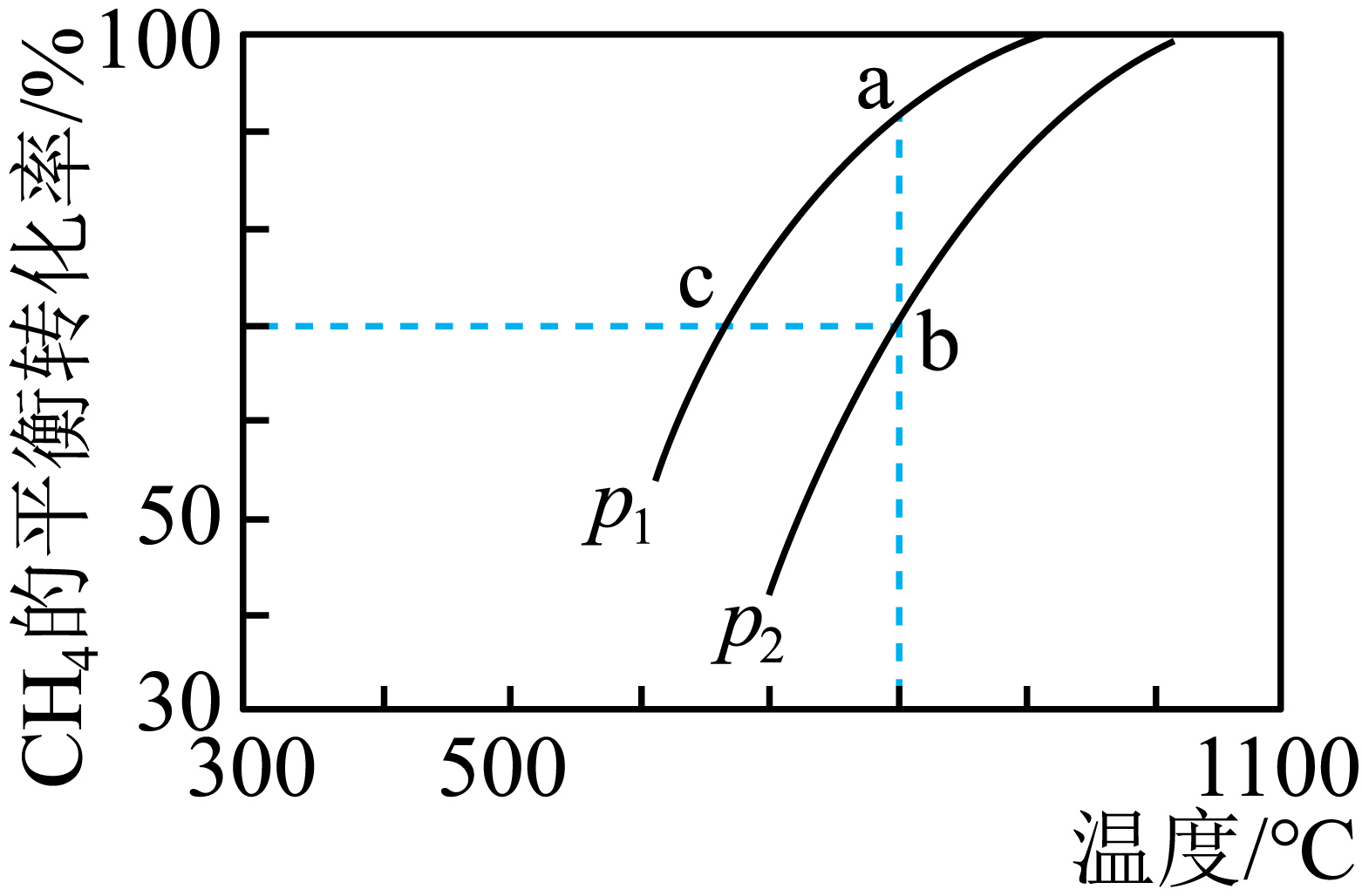
$\\rm \\lt $; $\\rm \\gt $
"]]对于反应$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+\text{C}{{\text{H}}_{4}}\left( \text{g} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)$来说,在温度相同的条件下,增大压强,平衡逆向移动,$\rm CH_{4}$的转化率降低,则有$P_{1}\lt P_{2}$,压强越大,反应速率越快,则化学反应速率$v(\text a)\lt v(\text b)$;压强不变的条件下,升高温度,$\rm CH_{4}$的转化率升高,平衡正向移动,平衡常数$\rm K$增大,则$K(\text a)\gt K(\text c)$;
科学家设计利用可再生能源$\rm ($如风能、太阳能$\rm )$电催化还原二氧化碳制备多碳产物$\rm ($如乙烯、乙醇、丙烷等$\rm )$,实现资源的再利用和碳循环,装置如图所示。
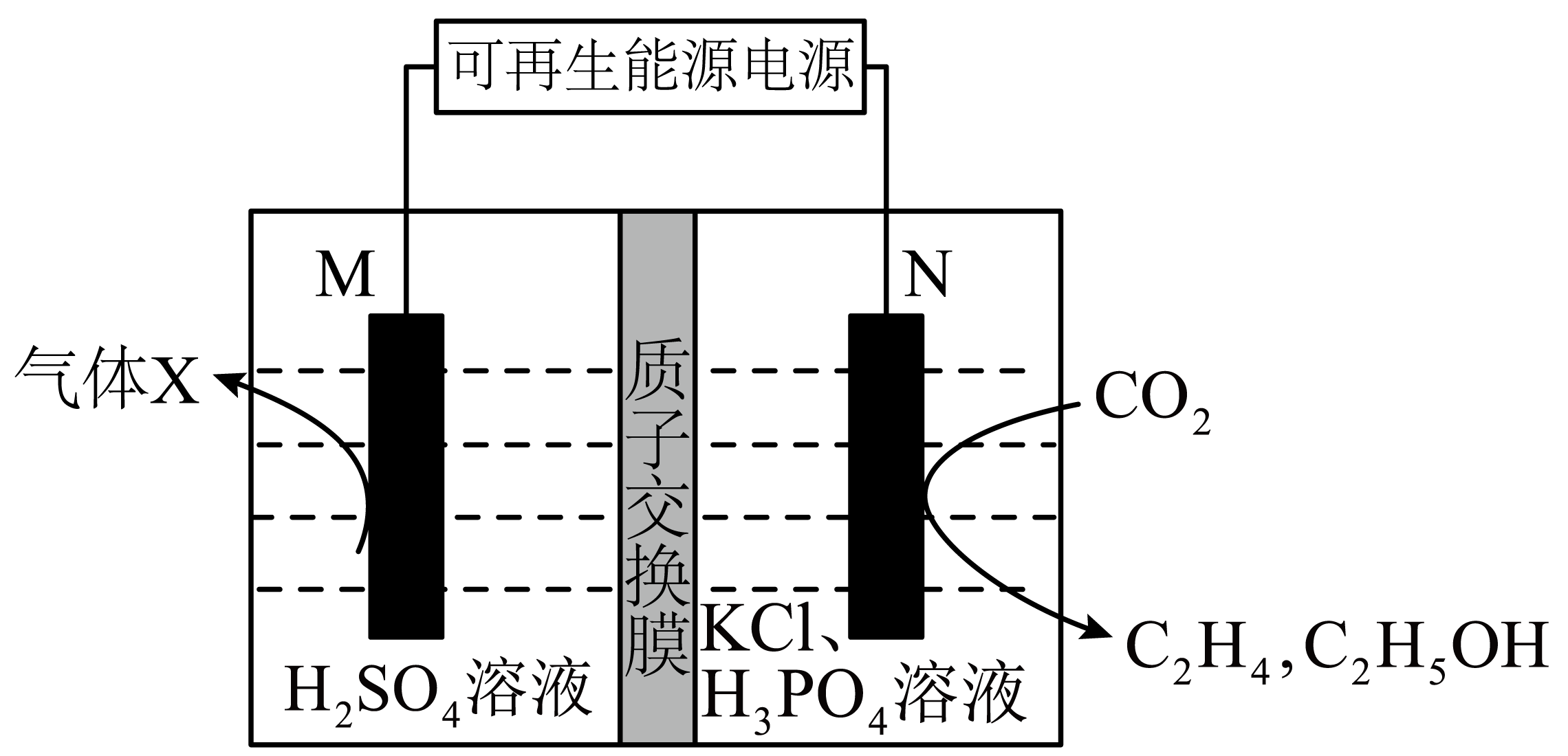
①$\rm M$极接电源的 极$\rm ($填“正”或“负”$\rm )$。
②写出生成乙烯$\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)$的电极反应式: 。
③${{\text{H}}^{+}}$经质子交换膜由 $\rm ($填“左侧向右侧”,或“右侧向左侧”$\rm )$移。
正; $\\text{2C}{{\\text{O}}_{\\text{2}}}\\text{+12}{{\\text{e}}^{-}}\\text{+12}{{\\text{H}}^{+}}\\text{=C}{{\\text{H}}_{\\text{2}}}\\text{=C}{{\\text{H}}_{\\text{2}}}\\text{+4}{{\\text{H}}_{\\text{2}}}\\text{O}$ ;由左侧向右
"]]由图可知,$\rm N$极碳元素化合价降低得电子,故$\rm N$极为阴极,$\rm M$电极为阳极,发生氧化反应,连接电源的正极;
①由上述分析可知,$\rm M$接电源的正极;
②$\rm N$为阴极,$\rm CO_{2}$得到电子生成乙烯,反应方程式为$\text{2C}{{\text{O}}_{\text{2}}}\text{+12}{{\text{e}}^{-}}\text{+12}{{\text{H}}^{+}}\text{=C}{{\text{H}}_{\text{2}}}\text{=C}{{\text{H}}_{\text{2}}}\text{+4}{{\text{H}}_{\text{2}}}\text{O}$;
③$\rm N$极消耗的氢离子,$\rm M$极电极反应式为$\text{2}{{\text{H}}_{\text{2}}}\text{O-4}{{\text{e}}^{-}}={{\text{O}}_{\text{2}}}\uparrow \text{+4}{{\text{H}}^{+}}$,产生$\rm H^{+}$,${{\text{H}}^{+}}$经质子交换膜由左侧向右侧移动。
高中 | 化学反应速率的相关计算题目答案及解析(完整版)
