高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
羰基硫$\rm (COS)$,广泛应用于农药、医药及其他化工生产领域。利用$\rm CO_{2}$和$\rm H_{2}S$制备$\rm COS$的反应如下:
主反应:${\rm H_{2}S(g)+CO_{2}(g)\rightleftharpoons \rm COS(g)+H_{2}O(g)}\qquad\Delta H_{1}=+35.0\;\rm kJ·mol$⁻¹
副反应Ⅰ:${\rm 2H_{2}S(g)\rightleftharpoons \rm S_{2}(g)+2H_{2(}g)}\qquad \Delta H_{2}=+171.58\;\rm kJ·mol$⁻¹
副反应Ⅱ:${\rm 2H_{2}S(g)+3CO_{2}(g)⇌3CO(g)+S_{2}(g)+2H_{2}O(g)}\qquad\Delta H_{3}=+253.98\;\rm kJ·mol$⁻¹
回答下列问题:
已知:$\rm 298\;K$时,$\rm 18\;\rm g$气态水转化为液态水释放$\rm 44\;\rm kJ$能量;$\rm H_{2}S(g)$的标准燃烧热为$ \Delta H=-586.0\;\rm kJ·mol^{-1}$,则$\rm COS(g)$的标准燃烧热$ \Delta H=$ $\rm \;\rm kJ·mol^{-1}$,副反应Ⅱ在 $\rm ($填“高温”“低温”或“任意温度”$\rm )$下能自发进行。
$\\rm -577$;高温
"]]设①$\text{COS(g)+}\dfrac{3}{2}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{C}{{\text{O}}_{\text{2}}}\text{(g)+S}{{\text{O}}_{\text{2}}}\text{(g)}\qquad\Delta H=x\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
已知:$\rm H_{2}S(g)$的标准燃烧热为$ \Delta H=-586.0\;\rm kJ·mol^{-1}$,得②:${{\text{H}}_{\text{2}}}\text{S(g)+}\dfrac{3}{2}{{\text{O}}_{\text{2}}}\text{(g)}\rightleftharpoons {{\text{H}}_{\text{2}}}\text{O(l)+S}{{\text{O}}_{\text{2}}}\text{(g)}\qquad\Delta H=-586.0\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
已知:$\rm 298\;K$时,$\rm 18\;\rm g$气态水转化为液态水释放$\rm 44\;\rm kJ$能量;得③:${\rm H_{2}O(g)=H_{2}O(l)}\qquad \Delta H=-44\;\rm kJ\cdot \rm mol^{-1}$,
根据盖斯定律,反应②$\rm -$①$\rm -$③$\rm =$主反应,则$ \Delta H_{1}={-586. 0\;\rm kJ\cdot \rm mol^{-1}}-x\;\rm kJ\cdot \rm mol^{-1}+44\;\rm kJ\cdot \rm mol^{-1}=+35.0\;\rm kJ\cdot \rm mol^{-1}$;得$ x=-577\;\rm kJ·mol^{-1}$,则$\rm COS(g)$的标准燃烧热$\rm \Delta H=-577\;\rm kJ·mol^{-1}$,副反应Ⅱ为气体体积增大的吸热反应,则$ \Delta H\gt 0$、$ \Delta S\gt 0$,自发进行时$ \Delta G=\Delta H-T·\Delta S \lt 0$,故在高温下能自发进行。
一定条件下,在一恒容密闭容器中通入一定量的$\rm H_{2}S(g)$和$\rm CO_{2}(g)$发生反应,下列说法正确的是 $\rm ($填字母代号$\rm )$。
$\rm a$.向该容器内充入一定量$\rm Ar$,反应达到平衡的时间将缩短
$\rm b$.主反应的正反应活化能一定小于副反应Ⅰ的正反应活化能
$\rm c$.当$v_{正}{\rm (H_{2}S)}=2v_{逆}{\rm (S_{2})}+v_{逆}\rm (COS)$时,反应达到平衡状态
$\rm d$.若在恒温恒压体系中进行,平衡时$\rm H_{2}S (g)$的平衡转化率增大
$\\rm cd$
"]]$\rm a$.向该容器内充入一定量$\rm Ar$,反应相关物质的浓度均不变,则反应速率不变,反应达到平衡的时间不变,$\rm a$错误;
$\rm b$.活化能是反应发生所需克服的能量壁垒,其大小取决于反应路径的能垒高度,主反应和副反应的活化能高低由各自的反应机理决定,且催化剂等可能选择性改变主$\rm /$副反应的活化能,则主反应的正反应活化能不一定小于副反应Ⅰ的正反应活化能,$\rm b$错误;
$\rm c$.根据化学方程式中的化学计量数关系以及硫元素周恒可知,当$v_{正}{\rm (H_{2}S)}=2v_{逆}{\rm (S_{2})}+v_{逆}\rm (COS)$时,可使$\rm H_{2}S$、$\rm S_{2}$、$\rm COS$等各成分的浓度保持不变,则反应达到平衡状态,$\rm c$正确;
$\rm d$.主反应中气体的物质的量不变,副反应中气体的物质的量增大,若在恒温恒压体系中进行,容积扩大,副反应均右移,则平衡时$\rm H_{2}S (g)$的平衡转化率增大,$\rm d$正确;
选$\rm cd$。
一定条件下,向恒容密闭容器中通入等物质的量的$\rm CO_{2}(g)$和$\rm H_{2}S(g)$混合气体,起始压强为$\rm 100\;\rm kPa$,发生上述反应,$\rm 20\;\rm min$时达到平衡,测得体系总压强为$\rm 110\;\rm kPa$,$\rm S_{2}(g)$的平均反应速率为 $\rm kPa·min^{-1}$,又${ p\rm(COS)}=p{\rm(CO_{2})}=p{ \rm(CO)}+p\rm(S_{2})$,则$\rm H_{2}S(g)$的平衡转化率为 ,主反应的压强平衡常数$ K\rm_{p}=$ 。
$\\rm 0.5$;$\\rm 80\\%$;$\\rm 3$
"]]一定条件下,向恒容密闭容器中通入等物质的量的$\rm CO_{2}(g)$和$\rm H_{2}S(g)$混合气体,起始压强为$\rm 100\;\rm kPa$,设$\rm CO_{2}(g)$和$\rm H_{2}S(g)$均为$\rm 1\;\rm mol$,发生上述反应,$\rm 20\;\rm min$时达到平衡,测得体系总压强为$\rm 110\;\rm kPa$,根据$\dfrac{{{p}_始{}}}{{{p}_平{}}}=\dfrac{{{n}_始{}}}{{{n}_平{}}}$,则平衡时混合气体共$\rm 2.2\;\rm mol$ ,根据 差量法可知, $\rm S_{2}(g)$物质的量等于增加的气体的物质的量,即$\rm 0.2\;\rm mol$ ,则$\rm S_{2}(g)$的平均反应速率为$\dfrac{\dfrac{0.{2\;\rm mol}}{{2}{.2\;\rm mol}}\times {110\;\rm kPa}}{20\;\rm {min}}=\rm 0.5\;\rm kPa·min^{-1}$,
又$p{\rm(COS)}=p{\rm(CO_{2})}=p{\rm(CO)}+p{\rm(S_{2})}$,则$n{\rm(COS)}=n{\rm(CO_{2})}=n{\rm(CO)}+n{\rm(S_{2})}\rm =n{\rm(CO)}+\rm 0.2\;\rm mol$,根据碳元素守恒,可知$n{\rm(COS)}=n{\rm(CO_{2})}=\rm 0.4\;\rm mol$, $n{\rm(CO)}=\rm 0.2\;\rm mol$,根据硫元素守恒,可得$n{\rm(H_{2}S)}=\rm 0.2\;\rm mol$,根据氧元素守恒,可得$n{\rm(H_{2}O)}=\rm 0.6\;\rm mol$,根据氢元素守恒,可得$n{\rm(H_{2})}\rm =\rm 0.2\;\rm mol$,消耗硫化氢为$\rm 1\;\rm mol\rm -\rm 0.2\;\rm mol\rm =\rm 0.8\;\rm mol$,则$\rm H_{2}S{\rm(g)}$的平衡转化率为$\rm 80\%$,主反应的压强平衡常数
$K\text{p}=\dfrac{p({{\text{H}}_{\text{2}}}\text{O})\cdot p(\text{COS})}{p({{\text{H}}_{2}}\text{S})\cdot p(\text{C}{{\text{O}}_{\text{2}}})}=\dfrac{\dfrac{0.4\;\rm \text{mol}}{2.2\;\rm \text{mol}}\times 110\;\rm \text{kPa}\times \dfrac{0.6\;\rm \text{mol}}{2.2\;\rm \text{mol}}\times 110\;\rm \text{kPa}}{\dfrac{0.2\;\rm \text{mol}}{2.2\;\rm \text{mol}}\times 110\;\rm \text{kPa}\times \dfrac{0.4\;\rm \text{mol}}{2.2\;\rm \text{mol}}\times 110\;\rm \text{kPa}}=3$。
将等物质的量的$\rm CO_{2}(g)$和$\rm H_{2}S(g)$混合气体充入恒容密闭容器中发生上述反应,反应物的转化率随温度的变化如下图:
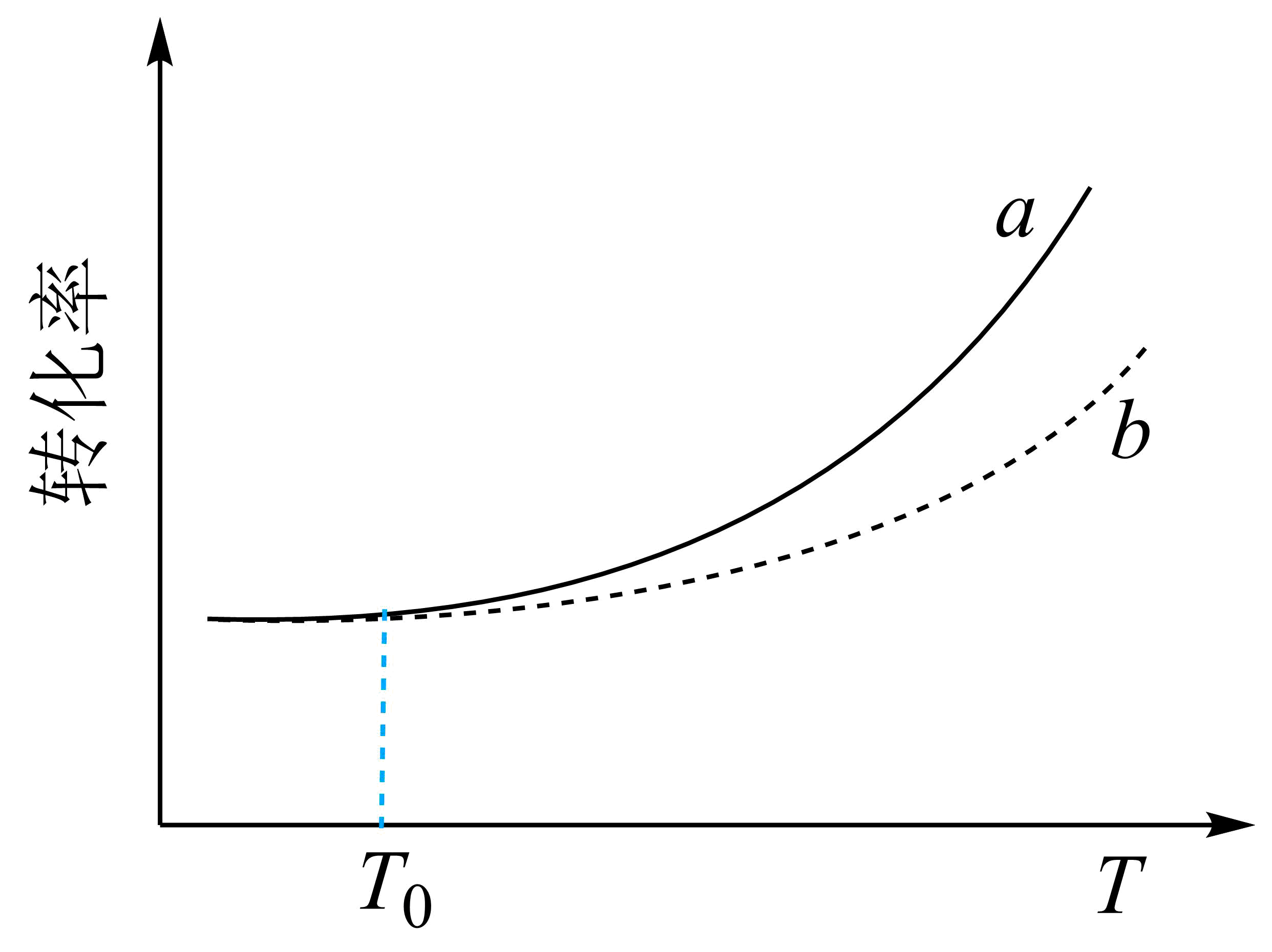
表示$\rm CO_{2}$的转化率随温度的变化曲线为 $\rm ($填“$\rm a$”或“$\rm b$”$\rm )$,在温度低于$T_0$时,二者转化率近似相等,可能的原因 。
$\\rm b$;副反应$\\rm I$几乎不发生$\\rm ($或以主反应为主,或以主反应及副反应$\\rm II$为主,或其他合理答案$\\rm )$
"]]由图可知,温度低于$T_0$时,二者转化率近似相等,可推测此条件下,副反应$\rm I$几乎不发生$\rm ($或以主反应为主,或以主反应及副反应Ⅱ为主,升温三个反应平衡右移,则温度升高对副反应反应$\rm I$更有利,导致硫化氢的转化率增大幅度大于二氧化碳的。则表示$\rm CO_{2}$的转化率随温度的变化曲线为$\rm b$,在温度低于$T_0$时,二者转化率近似相等,可能的原因:副反应$\rm I$几乎不发生$\rm ($或以主反应为主,或以主反应及副反应Ⅱ为主。
高中 | 化学平衡常数题目答案及解析(完整版)
