高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
用磷石膏$\rm ($主要成分是$\text{CaS}{{\text{O}}_{\text{4}}}\cdot \text{2}{{\text{H}}_{\text{2}}}\text{O}\rm )$可生产硫酸或硫。回答下列问题:
用硫黄还原磷石膏。已知下列反应:
①$\text{3CaS}{{\text{O}}_{4}}\text{(s)+CaS(s)=4CaO(s)+4S}{{\text{O}}_{2}}\text{(g)}\qquad\Delta {{ {H}}_{1}}$
②$\text{CaS}{{\text{O}}_{4}}\text{(s)+3CaS(s)=4CaO(s)+4S(s)}\qquad\Delta {{ {H}}_{2}}$
则反应:$\text{2CaS}{{\text{O}}_{4}}\text{(s)+S(s)=2CaO(s)+3S}{{\text{O}}_{2}}\text{(g)}$的$\Delta {H}=$ 。$\rm ($用$\Delta {{ {H}}_{1}}$和$\Delta {{ {H}}_{2}}$表示$\rm )$。
$\\Delta H =\\dfrac{{3 }\\Delta{ }{{{H}}_{{1}}}{- }\\Delta{ }{{{H}}_{{2}}}}{{4}}$
"]]目标方程式可由$\dfrac{3}{4}$得到,根据盖斯定律得$\Delta H =\dfrac{{3 }\Delta{ }{{{H}}_{{1}}}{- }\Delta{ }{{{H}}_{{2}}}}{{4}}$;
用高硫煤还原磷石膏。温度对等时间内$\mathrm{CaSO}_4$转化率影响的曲线如图甲所示,$\text{CaC}{{\text{l}}_{2}}$的作用是 ;当温度高于$1200\;{}^\circ \text{C}$时,两条曲线趋于相同的可能原因是 。
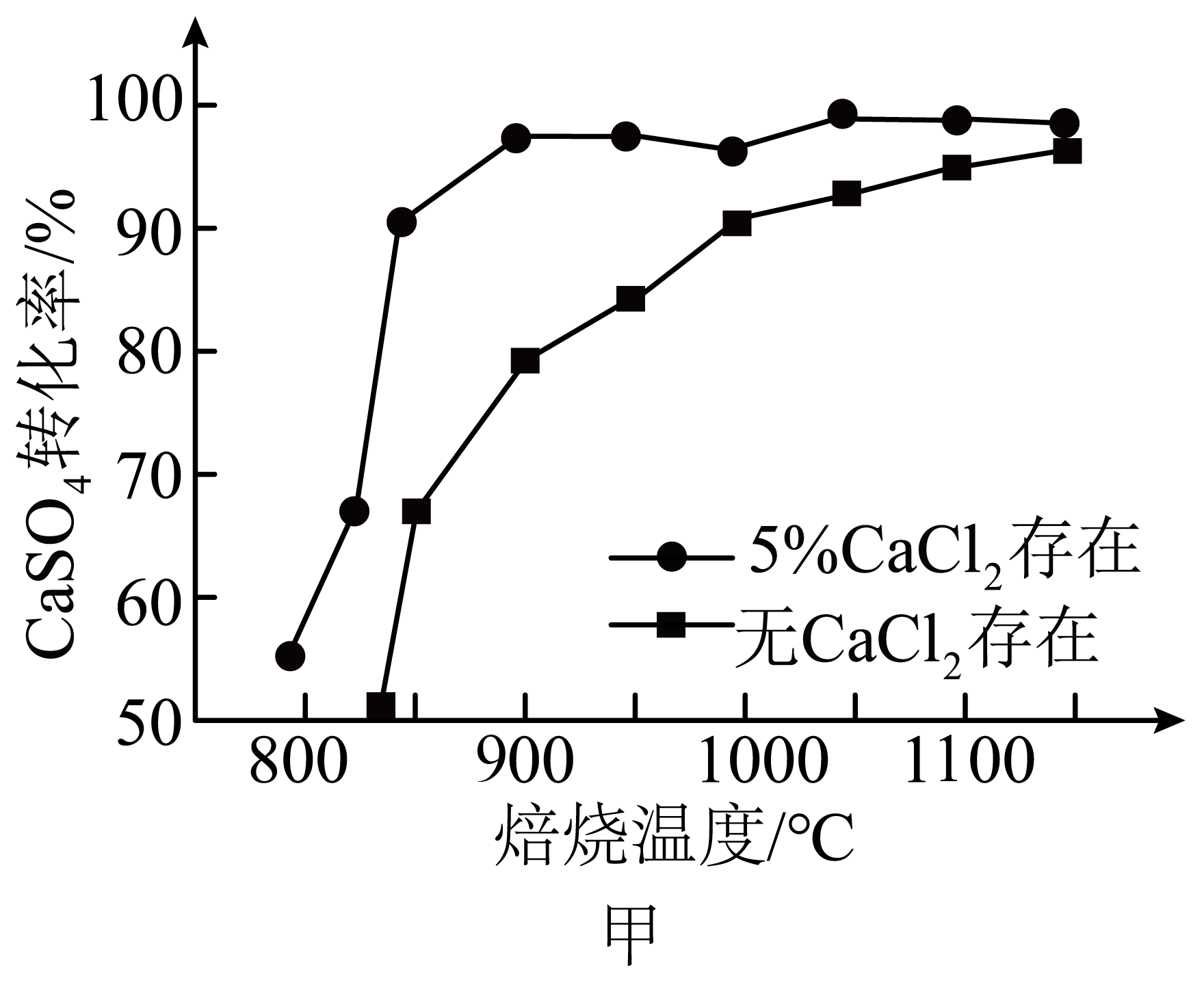
作催化剂降低反应活化能,节约能源;两种情况下反应均趋于平衡,催化剂$\\text{CaC}{{\\text{l}}_{2}}$不影响平衡
"]]由图甲可知,$\rm CaCl_{2}$改变反应速率,但不改变最终(平衡时)$\rm CaSO_{4}$的转化率,说明$\rm CaCl_{2}$作催化剂;当温度高于$\rm 1200\;\rm ^\circ\rm C$时,两种情况均达到平衡状态,则无论有无$\rm CaCl_{2}$,$\rm CaSO_{4}$的转化率趋于相同;
用$\text{CO}$还原磷石膏。不同反应温度下可得到不同的产物。
①低于$800\;{}^\circ \text{C}$时,主要的还原产物是一种硫的最低价盐,该物质的化学式是 。
②$\text{1150}\;{}^\circ \text{C}$下,向盛有足量$\mathrm{CaSO}_4$的真空恒容密闭容器中充入$\text{CO}$,起始压强为$\text{0} {.1a\;\rm MPa}$,主要发生反应:$\text{CaS}{{\text{O}}_{\text{4}}}\text{(s)+CO(g)}\rightleftharpoons \text{CaO(s)+C}{{\text{O}}_{\text{2}}}\text{(g)+S}{{\text{O}}_{\text{2}}}\text{(g)}$。该反应达到平衡时,$ {c\rm (S}{{\text{O}}_{\text{2}}}\text{)=8}\text{.0}\times \text{1}{{\text{0}}^{\text{-5}}}\text{ mol}\cdot {{\text{L}}^{\text{-1}}}$,$\text{CO}$的转化率为$\rm 80\%$,则初始时$c\text{(CO)}=$ $\mathrm{mol} \cdot \mathrm{L}^{-1}$,该反应的分压平衡常数中${{K}_{\text{p}}}=$ $\text{MPa}$。$\rm ($分压$\rm =$总压$\rm \times $物质的量分数,忽略副反应$\rm )$。
$\\text{CaS}$;$\\rm 1.0\\times 10^{-4}$;$0.32a$
"]]$\rm S$的最低价态为$\rm -2$价,则最低价盐为$\rm CaS$;根据反应可知存在计量关系:$\rm CO\sim SO_{2}\sim CO_{2}$,则反应掉的$\rm CO$为$\rm 8.0\times 10^{-5}\;\rm mol/L$,则初始$\rm CO$的浓度为$\dfrac{8.0\times {{10}^{-5}}\;\rm mol/{L}}{80\%}=1.0\times {{10}^{-4}}\;\rm mol/{L}$;平衡时,$c\rm (CO_{2})= 8.0\times 10^{-5}\;\rm mol/L$,$ c\rm (CO)=( 1.0\times 10^{-4}-8.0\times 10^{-5})\;mol/L=2\times 10^{-5}\;\rm mol/L$,则平衡时气体总物质的量浓度为$\left( 0.2+0.8+0.8 \right)\times {{10}^{-4}}\;\rm {mol}\cdot {{{L}}^{-1}}\rm =1.8\times 10^{-4}\;\rm mol/L$,设容器体积为$ V\rm \;L$,总压为$\dfrac{1.8\times {{10}^{-4}}{\;\rm {mol}\cdot {{{L}}^{-1}}}\times V\rm \;L}{1.0\times {{10}^{-4}}{\;\rm {mol}\cdot {\rm {{L}}^{-1}}}\times V\rm \;L}\times {0.1{a}\rm \;MPa}=0.18{a}\rm \;MPa$,${p\rm (CO_{2})}=\dfrac{0.8\times {{10}^{-4}}{V}}{1.8\times {{10}^{-4}}{V}}\times 0.18{a}{\rm \;MP a} = 0.08{a}{\rm \;MP{a}\rm} =p\rm (SO_{2})$,${ p\rm (CO)}=\dfrac{0.2\times {{10}^{-4}}{V}}{1.8\times {{10}^{-4}}{V}}\times 0.18{a}{\rm \;MP{a}}=0.02{a}\rm \;MP{a}$,$ K_{\rm p}=\dfrac{0.08{a\rm \; MPa}\times 0.08{a\rm \; MPa}}{0.02{a\rm \; MPa}}=0.32a\rm \;{MPa}$;
用$\rm C$还原磷石膏。向密闭容器中加入相同质量的几组不同$\rm C/S$值$\rm ($炭粉与$\mathrm{CaSO}_4$的物质的量之比$\rm )$的混合物,$1100\;{}^\circ \text{C}$煅烧至无气体产生,结果如图乙所示。
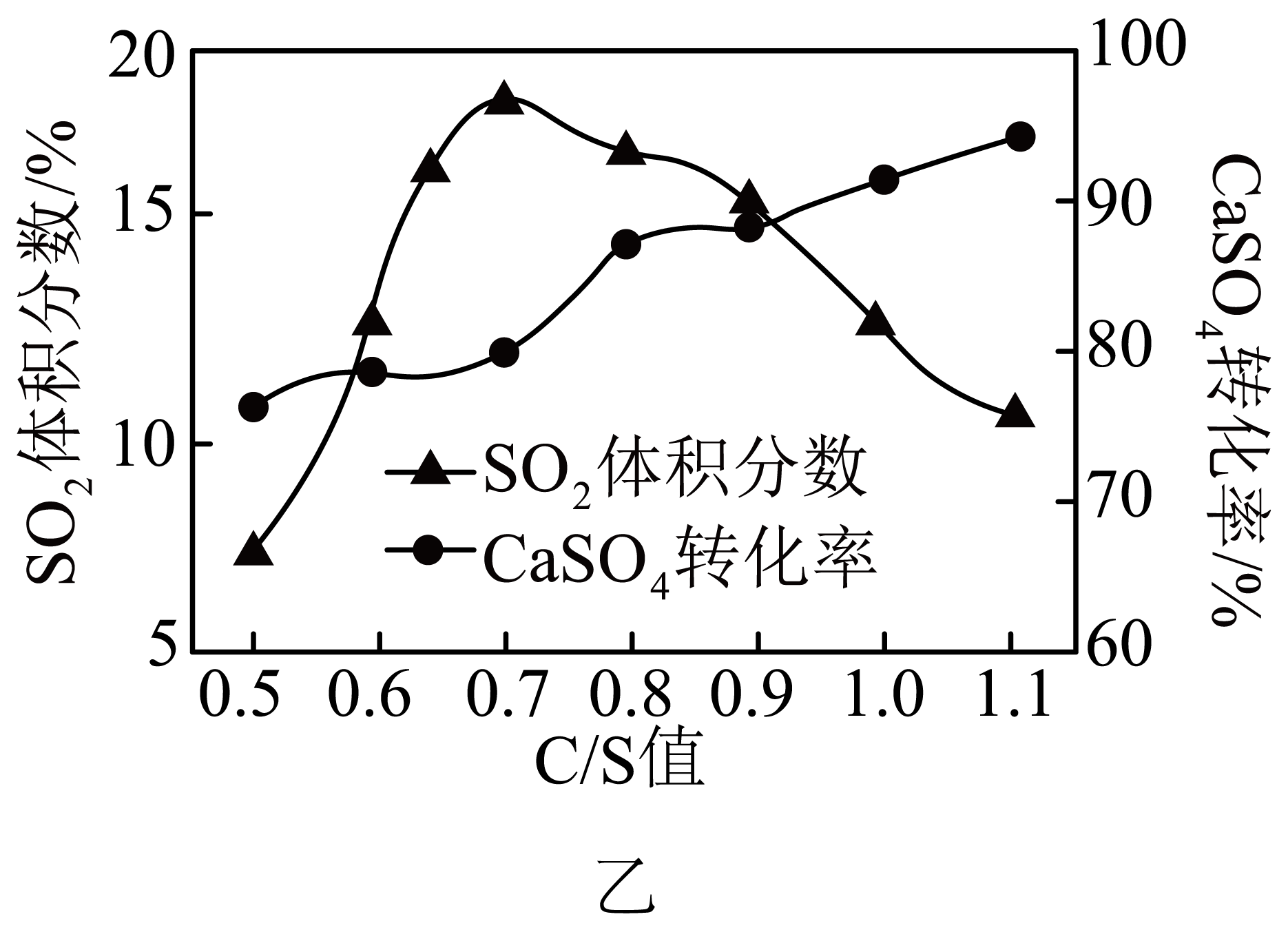
①当$\rm C/S$值为$\rm 0.5$时,试解释$\text{CaS}{{\text{O}}_{\text{4}}}$的转化率接近$\rm 80\%$,但$\text{S}{{\text{O}}_{2}}$的体积分数却低于$\rm 10\%$的原因 。
②当$\rm C/S$值大于$\rm 0.7$时,反应所得气体中$\text{S}{{\text{O}}_{2}}$的体积分数不升反降,可能的原因是 。
炭粉与$\\mathrm{CaSO}_4$主要的产物$\\text{CaS}$和$\\text{CO}$,少部分生成$\\text{CaO}\\text{C}{{\\text{O}}_{2}}$和$\\text{S}{{\\text{O}}_{2}}$;高温下,过量的$\\rm C$与$\\text{C}{{\\text{O}}_{2}}$反应生成$\\rm CO$,使气体总体积增大或$\\mathrm{CaSO}_4$部分转化为其他含硫物质
"]]主要原因是其中大部分$\rm CaSO_{4}$与$\rm C$反应转化成$\rm CaS$和$\rm CO$,少部分转化成$\rm CaO$、$\rm CO_{2}$、$\rm SO_{2}$,故$\rm SO_{2}$含量少;当$\rm C/S$值大于$\rm 0.7$,过量的$\rm C$与$\rm CO_{2}$反应生成$\rm CO$,使气体总体积增大导致$\rm SO_{2}$体积分数不增反减或$\rm CaSO_{4}$部分转化为其他含硫物质;
生产硫酸:依上述四种还原途径,分析用磷石膏生产硫酸比较适宜途径和条件是 。
用$\\rm C$还原磷石膏,$\\rm C/S$值为$\\rm 0.7$;$900\\;{}^\\circ \\text{C}$,$\\text{CaC}{{\\text{l}}_{2}}$作催化剂
"]]考虑实际生产成本和转化率,应选择用$\rm C$还原磷石膏,$\rm C/S$值选择$\rm 0.7$;另外加入$\rm CaCl_{2}$催化剂可以提高生产效率,温度选择$\rm 900\;\rm ^\circ\rm C$(温度太低$\rm CaSO_{4}$易生成$\rm CaS$,且$\rm 900\;\rm ^\circ\rm C$时$\rm CaCl_{2}$催化效果很好)。
高中 | 化学平衡常数题目答案及解析(完整版)
