高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$ T$ $\rm K$下,分别向三个容积不等的恒容密闭容器中投入$\rm 1\;\rm mol$ $\rm SOCl_{2}$和$\rm 1\;\rm mol$ $\rm H_{2}S$发生反应:$\text{SOC}{{\text{l}}_{2}}(\text{g})+{{\text{H}}_{2}}\text{S}(\text{g})\rightleftharpoons {{\text{S}}_{2}}\text{O}(\text{g})+2\text{HCl}(\text{g})$,反应$ t$ $\rm min$后,三个容器中$\rm SOCl_{2}$的转化率如图所示。下列说法正确的是$(\qquad)$
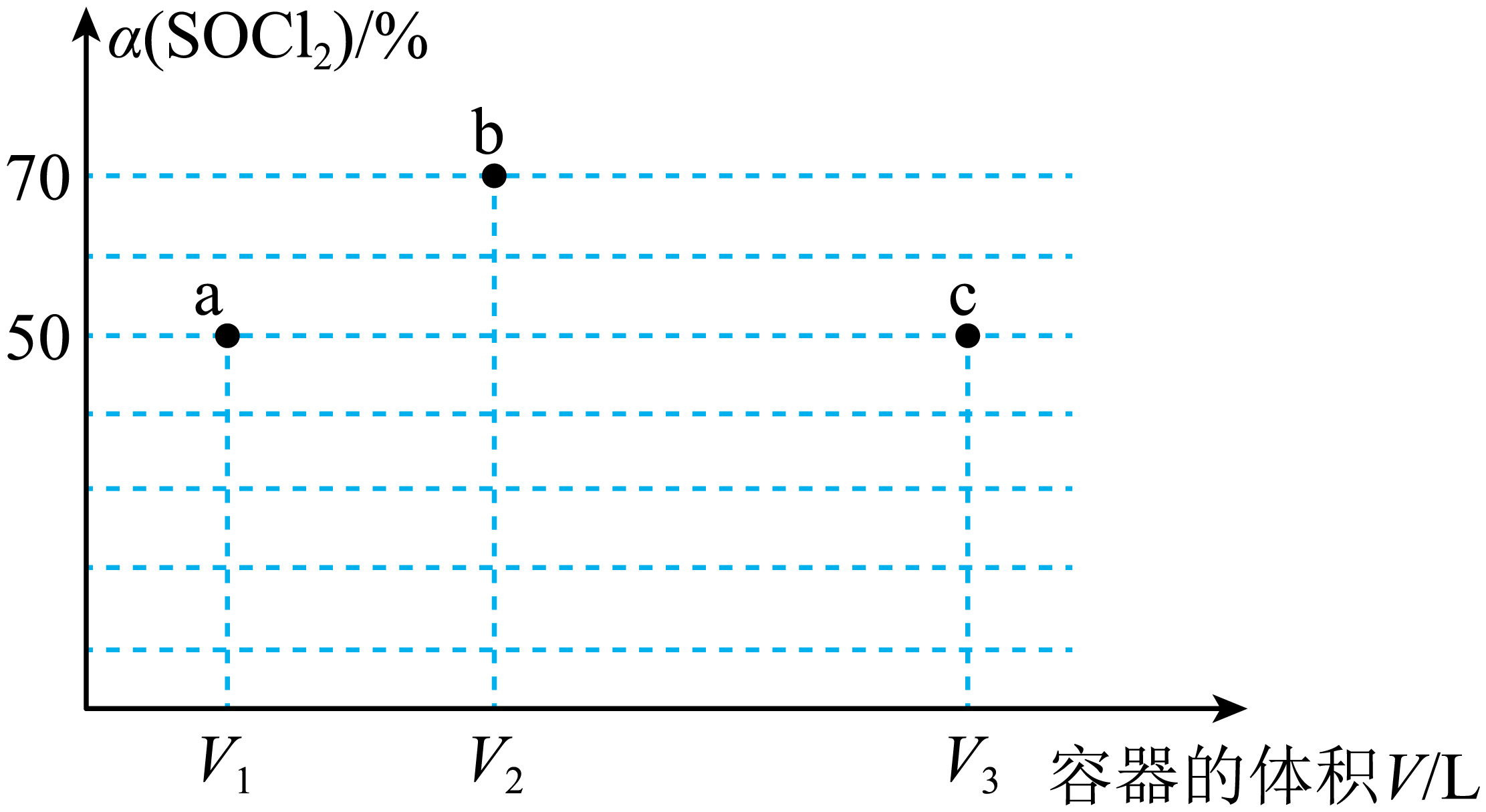
$ 0\\sim t$ $\\rm min$内,三个容器中的正反应速率:${{v}_{\\text{a}}}={{v}_{\\text{c}}}\\lt {{v}_{\\text{b}}}$
","$\\rm b$点为平衡转化率,$\\rm a$、$\\rm c$点不是平衡转化率
","$ T$ $\\rm K$时,该反应的平衡常数为$\\rm 2$ $\\rm mol·L^{-1}$
","$ V_{1}$ $\\rm L$容器中反应达到平衡后,若再投入$\\rm 1\\;\\rm mol$ $\\rm SOCl_{2}$和$\\rm 1\\;\\rm mol$ $\\rm S_{2}O$,平衡不移动
"]$\rm A$.$ 0\sim t$ $\rm min$内,以$\rm SOC{{l}_{2}}$表示正反应速率,${{{v}}_{\rm {a}}}=\dfrac{0.5}{{{{V}}_{1}}\times {t}}{\rm \;mol}\rm \cdot {{{L}}^{-1}}\cdot {mi}{{{n}}^{-1}}$,${{{v}}_{{\rm b}}}=\dfrac{0.7}{{{{V}}_{2}}\times {t}}\rm \;{mol}\cdot {{{L}}^{-1}}\cdot {mi}{{{n}}^{-1}}$,${{{v}}_{\rm {c}}}=\dfrac{0.5}{{{{V}}_{3}}\times {t}}\rm \;{mol}\cdot {{{L}}^{-1}}\cdot {mi}{{{n}}^{-1}}$,容积:${{{V}}_{1}}\lt {{{V}}_{2}}\lt {{{V}}_{3}}$,所以正反应速率:${{v}_\rm {{a}}}\gt {{v}_\rm {{c}}}$,$\rm A$错误;
$\rm B$.三个容器中的$\rm SOCl_{2}$的转化率:$\rm b\gt a=c$,浓度大时速率快,$\rm a$点的转化率比$\rm b$点低,说明$\rm a$点达到了平衡,则可推知$\rm a$点是平衡点,$\rm b$、$\rm c$点不是平衡点,$\rm B$错误;
$\rm C$.根据平衡点$\rm a$点列三段式:$\rm \begin{matrix} {} & \rm {SOC}{{{l}}_{{2}}}\left( {g} \right) & + & \rm {{{H}}_{{2}}}{S}\left( {g} \right) & \rightleftharpoons &\rm {{{S}}_{{2}}}{O}\left( {g} \right) & + &\rm {2HCl}\left( {g} \right) \\起始物质的量 {\rm mol} & {1} & {} & {1} & {} & {0} & {} & {0} \\ 转移物质的量{\rm mol} & {0}{.5} & {} & {0}{.5} & {} & {0}{.5} & {} & {1} \\ 平衡物质的量{\rm mol} & {0}{.5} & {} & {0}{.5} & {} & {0}{.5} & {} & {1} \\ \end{matrix}$
${K}=\dfrac{\dfrac{0.5}{{{{V}}_{1}}}\times {{\left( \dfrac{1}{{{{V}}_{1}}} \right)}^{2}}}{\dfrac{0.5}{{{{V}}_{1}}}\times \dfrac{0.5}{{{{V}}_{1}}}}{\rm \;mol}\cdot {{\rm {L}}^{-1}}=\dfrac{2}{{{{V}}_{1}}}\rm \;{mol}\cdot {{{L}}^{-1}}$,$\rm C$错误;
$\rm D$.若再投入$\rm 1\;\rm mol$ $\rm SOCl_{2}$和$\rm 1\;\rm mol$ $\rm S_{2}O$,${Q}=\dfrac{\dfrac{1.5}{{{{V}}_{1}}}\times {{\left( \dfrac{1}{{{{V}}_{1}}} \right)}^{2}}}{\dfrac{1.5}{{{{V}}_{1}}}\times \dfrac{0.5}{{{{V}}_{1}}}}{\rm \;mol}\cdot {{\rm {L}}^{-1}}=\dfrac{2}{{{{V}}_{1}}}{\rm \;{mol}\cdot {{{L}}^{-1}}}={K}$,平衡不移动,$\rm D$正确。
故选:$\rm D$
高中 | 化学平衡常数题目答案及解析(完整版)
