高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
环氧乙烷$\rm ({{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}\rm )$是一种重要的化工原料。现代工业常用银作催化剂,氧化乙烯制备环氧乙烷。发生的主要反应有:
$\rm I$.$2{{\text{C}}_{2}}{{\text{H}}_{4}}(\text{g})+{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2{{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}(\text{g})\quad \Delta {{H}_{1}}=-210\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
Ⅱ.${{\text{C}}_{2}}{{\text{H}}_{4}}(\text{g})+3{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2\text{C}{{\text{O}}_{2}}(\text{g})+2{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{2}}=-1239\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
回答下列问题:
已知银催化反应Ⅰ时存在如下转化过程:
$\begin{array}{*{35}{l}} {{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right)+\text{Ag}{{\text{O}}_{2}}\left( \text{s} \right)\xrightarrow{\Delta {{H}_{4}}}{{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}\left( \text{g} \right)+\text{AgO}\left( \text{s} \right) \\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\uparrow \Delta{{H}_{3}}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\downarrow \Delta{{H}_{5}} \\ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\text{Ag}\left( \text{s} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\text{Ag}\left( \text{s} \right)+\dfrac{1}{2}{{\text{O}}_{2}}\left( \text{g} \right) \\ \end{array}$
据此计算焓变$\Delta {{H}_{4}}=$ $\rm ($用含$\Delta{{H}_{1}}$、$\Delta{{\text{H}}_{3}}$、$\Delta {{H}_{5}}$的代数式表示$\rm )$。
$\\dfrac{1}{2}\\Delta {{H}_{1}}-\\Delta {{H}_{3}}-\\Delta {{H}_{5}}$
"]]根据题给信息可知,$I$.$2{{\text{C}}_{2}}{{\text{H}}_{4}}(\text{g})+{{\text{O}}_{2}}(\text{g})\rightleftharpoons 2{{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}(\text{g})\quad \Delta {{H}_{1}}=-210\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
Ⅲ.$\text{Ag}\left( \text{s} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{Ag}{{\text{O}}_{2}}\left( \text{s} \right)\quad \Delta {{H}_{3}}$
Ⅴ。$\text{AgO}\left( \text{s} \right)\rightleftharpoons \text{Ag}\left( \text{s} \right)+\dfrac{1}{2}{{\text{O}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{5}}$
结合盖斯定律可知,$\dfrac{1}{2}\times \text{I}-\text{Ⅲ}-\text{Ⅴ}$可得${{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right)+\text{Ag}{{\text{O}}_{2}}\left( \text{s} \right)\rightleftharpoons {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}\left( \text{g} \right)+\text{AgO}\left( \text{s} \right)$,故$\Delta {{H}_{4}}=\dfrac{1}{2}\Delta {{H}_{1}}-\Delta {{H}_{3}}-\Delta {{H}_{5}}$;
反应Ⅰ的正、逆反应速率可分别表示为${{v}_{正}}={{k}_{正}}\cdot {{p}^{2}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)\cdot p\left( {{\text{O}}_{2}} \right)$、${{v}_{逆}}={{k}_{逆}}\cdot {{p}^{2}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right) ({{k}_{正}}$、${{k}_{逆}}$分别为正、逆反应速率常数,$p$为物质的分压$\rm )$。$T\ {}^\circ \text{C}$时,${{k}_{正}}=3{{k}_{逆}}$,向某恒容密闭容器中充入$1\text{ mol }{{\text{C}}_{2}}{{\text{H}}_{4}}(\text{g})$和$2\text{ mol }{{\text{O}}_{2}}(\text{g})$发生反应Ⅰ和Ⅱ,一段时间后达平衡。
①反应Ⅰ的压强平衡常数${{K}_{\text{p}}}=$ ;仅降低温度,${{K}_{\text{p}}}$将 $\rm ($填“增大”“减小”或“不变”$\rm )$,解释其原因为 $\rm ($填选项字母$\rm )$。
$\rm A$.${{k}_{正}}$、${{k}_{逆}}$均增大,且${{k}_{正}}$增大的程度更大 $\rm B$.${{k}_{正}}$、${{k}_{逆}}$均减小,且${{k}_{逆}}$减小的程度更大
$\rm C$.${{k}_{正}}$增大、${{k}_{逆}}$减小,平衡正向移动 $\rm D$.${{k}_{正}}$、${{k}_{逆}}$均减小,且${{k}_{正}}$减小的程度更大
②下列情况能表明体系达到平衡状态的是 $\rm ($填选项字母$\rm )$。
$\rm A$.混合气体密度不随时间变化
$\rm B$.气体平均摩尔质量不随时间变化
$\rm C$.碳的总物质的量${{n}_{总}}=2n\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)+n\left( \text{C}{{\text{O}}_{2}} \right)+2n\left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right)$不随时间变化
$\rm D$.$2{{v}_{正}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)=2{{v}_{逆}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right)+{{v}_{逆}}\left( \text{C}{{\text{O}}_{2}} \right)$
$\\rm 3$ ; 增大 ; $\\rm B$ ; $\\rm BD$
"]]①根据${{k}_{正}}=3{{k}_{逆}}$,并结合平衡常数和速率常数的关系可知,${{K}_{\text{p}}}=\dfrac{{{k}_{正}}}{{{k}_{逆}}}=3$;反应Ⅰ为放热反应,降低温度时,平衡正向移动,平衡常数增大。温度降低时,速率常数降低,由于平衡正向移动,则逆向反应速率常数降低的更多;
②$\rm A$.该容器为恒容容器,且所有的反应物和产物都是气体,则混合气体密度是恒定不变的,则其不随时间变化时,不能证明反应达到平衡,$\rm A$错误;
$\rm B$.结合$\rm A$分析可知,反应物和产物的质量不变,且反应Ⅰ是气体分子数减小的反应,则气体平均摩尔质量不随时间变化可以证明反应达到平衡,$\rm B$正确;
$\rm C$.根据碳元素守恒可知,碳的总物质的量${{n}_{总}}=2n\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)+n\left( \text{C}{{\text{O}}_{2}} \right)+2n\left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right)$不随时间变化,则碳的总物质的量不变不能证明反应达到平衡,$\rm C$错误;
$\rm D$.平衡时,根据反应Ⅰ可知,$2{{v}_{正}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)=2{{v}_{逆}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right)$,根据反应Ⅱ可知,$2{{v}_{正}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)={{v}_{逆}}\left( \text{C}{{\text{O}}_{2}} \right)$,则两者式子结合到一起可知,$2{{v}_{正}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}} \right)=2{{v}_{逆}}\left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right)+{{v}_{逆}}\left( \text{C}{{\text{O}}_{2}} \right)$,$\rm D$正确;
故选:$\rm BD$;
$\rm 250$ $\rm ^\circ\rm C$时,将$1\text{ mol }{{\text{C}}_{2}}{{\text{H}}_{4}}(\text{g})$和$2\text{ mol }{{\text{O}}_{2}}(\text{g})$充入某密闭容器中发生反应Ⅰ和Ⅱ,在不同压强下达平衡。测得平衡时,${{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}$选择性$\left[ \delta \left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right) \right]$、$\text{C}{{\text{O}}_{2}}$选择性$\left[ \delta \left( \text{C}{{\text{O}}_{2}} \right) \right]$及${{\text{C}}_{2}}{{\text{H}}_{4}}$转化率随压强变化的曲线如图所示$\rm [$如$\delta \left( \text{C}{{\text{O}}_{2}} \right)=\dfrac{转化为\text{C}{{\text{O}}_{2}}的乙烯的物质的量}{反应的乙烯的总物质的量}\rm ]$。
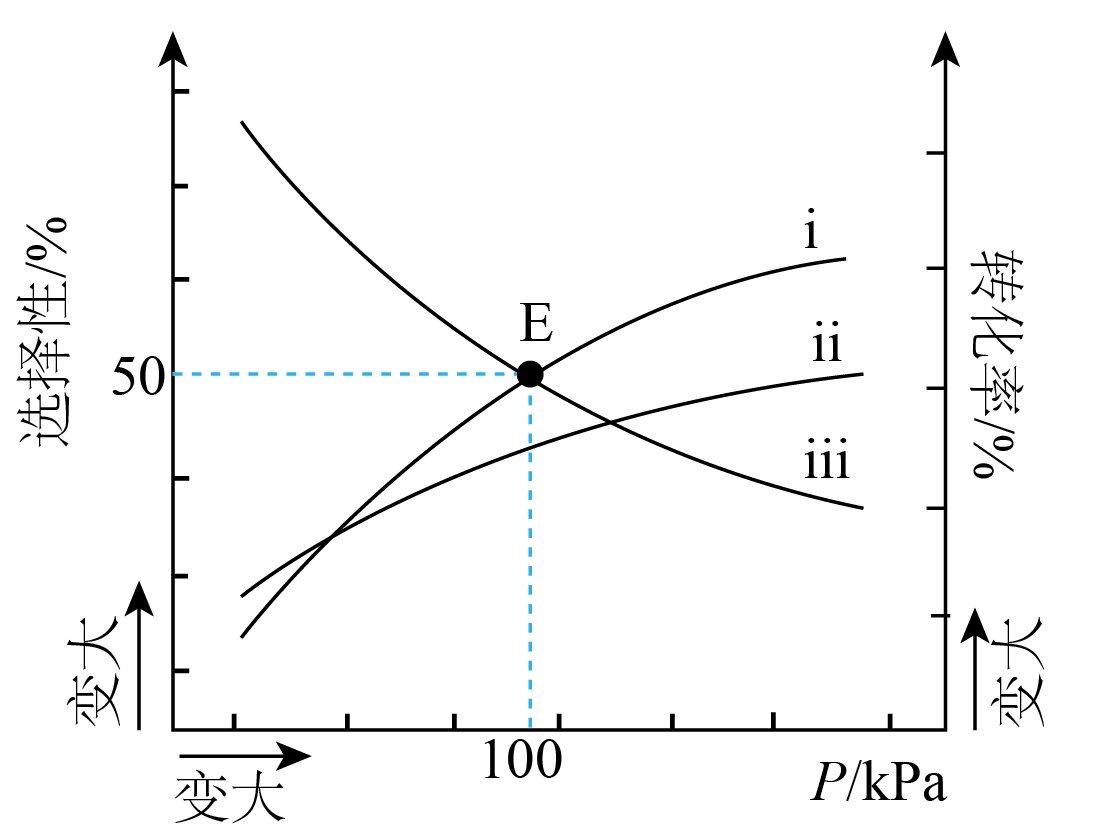
①表示$\delta \left( \text{C}{{\text{O}}_{2}} \right)$随压强变化的曲线为 $\rm ($填ⅰ、ⅱ或ⅲ$\rm )$。
②当压强为$\rm 100$ $\rm kPa$时,若${{\text{O}}_{2}}$的转化率为$\rm 56\%$,则此时乙烯的转化率为 。
③若将$\rm E$点对应体系降温至$\rm 200$ $\rm ^\circ\rm C$,重新达平衡时,测得$\dfrac{\delta \left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right)}{\delta \left( \text{C}{{\text{O}}_{2}} \right)}\lt 1$,解释其原因为 。
ⅲ ;$\\rm 64\\%$ ; 反应Ⅰ和Ⅱ的$\\Delta H$均$\\rm \\lt 0$,降温均正向移动,反应Ⅱ正向移动的程度比Ⅰ大
"]]①随着压强增大,反应$\rm I$正向移动,反应Ⅱ平衡不移动,则加压时,${{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}$的选择性增大,即$\rm i$表示${{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}$的选择性,结合题意可知,${{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}$选择性$\left[ \delta \left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right) \right]$、$\text{C}{{\text{O}}_{2}}$选择性$\left[ \delta \left( \text{C}{{\text{O}}_{2}} \right) \right]$之和为$\rm 100\%$,则表示$\delta \left( \text{C}{{\text{O}}_{2}} \right)$随压强变化的曲线为ⅲ;同时可知,ⅱ表示${{\text{C}}_{2}}{{\text{H}}_{4}}$转化率;
②若${{\text{O}}_{2}}$的转化率为$\rm 56\%$,则参加反应的${{\text{O}}_{2}}$的物质的量为$\rm 1.12$ $\rm mol$,设反应$\rm I$生成${{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}2x\text{ mol}$,反应Ⅱ生成$\text{C}{{\text{O}}_{2}}\text{ }2y\text{ mol}$,结合反应$\rm I$、反应Ⅱ可知,反应$\rm I$消耗乙烯$2x\text{ mol}$,氧气$x\text{ mol}$,反应Ⅱ消耗乙烯$y\text{ mol}$,氧气$3y\text{ mol}$,且当压强为$\rm 100$ $\rm kPa$时,${{\text{C}}_{2}}{{\text{H}}_{4}}\text{O}$选择性、$\text{C}{{\text{O}}_{2}}$选择性都是$\rm 50\%$,则$x+3y=1.12$,$y=2x$,$x=0.16$,$y=0.32$,则此时乙烯的转化率为$\dfrac{2\times 0.16\text{ mol}+0.32\text{ mol}}{1\text{ mol}}\times 100\%=64\%$;
③由于反应$\rm I$、反应Ⅱ均为放热反应,则降温时,两平衡均正向移动,但是反应Ⅱ的热效应大,即降温时,其正向移动的程度大,则$\text{C}{{\text{O}}_{2}}$的选择性大,则$\dfrac{\delta \left( {{\text{C}}_{2}}{{\text{H}}_{4}}\text{O} \right)}{\delta \left( \text{C}{{\text{O}}_{2}} \right)}\lt 1$。
高中 | 化学平衡常数题目答案及解析(完整版)
