| 盖斯定律 题目答案及解析
稿件来源:高途
| 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
乙炔加氢是除去乙烯中少量乙炔杂质,得到高纯度乙烯的重要方法。该过程包括以下两个主要反应:
反应$\rm 1$:${{\text{C}}_{2}}{{\text{H}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)={{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right)\qquad\Delta{{ {H}}_{1}}=-175\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\left( 25\;^\circ \rm C ,101\;\rm \text{kPa} \right)$
反应$\rm 2$:${{\text{C}}_{2}}{{\text{H}}_{2}}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)={{\text{C}}_{2}}{{\text{H}}_{6}}\left( \text{g} \right)\qquad\Delta{{ {H}}_{2}}=-312\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\left( 25\;^\circ \rm C ,101\;\rm \text{kPa} \right)$
$\rm 25\;\rm ^\circ\rm C$,$\rm 101\;\rm kPa$时,反应${{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)={{\text{C}}_{2}}{{\text{H}}_{6}}\left( \text{g} \right)\qquad\Delta{ H}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
$\\rm -137$
"]]由盖斯定律,②$\rm -$①可以得到目标反应,则$\Delta{H=}\Delta {{ {H}}_{2}}-\Delta {{ {H}}_{1}}=312\;\rm \text{kJ}/mol+175\;\rm kJ/mol=-137\;\rm kJ/mol$;
一定条件下,使用某含$\rm Co$催化剂,在不同温度下测得乙炔转化率和产物选择性$\rm ($指定产物的物质的量$\rm /$转化的乙炔的物质的量$\rm )$如图所示$\rm ($反应均未达平衡$\rm )$。
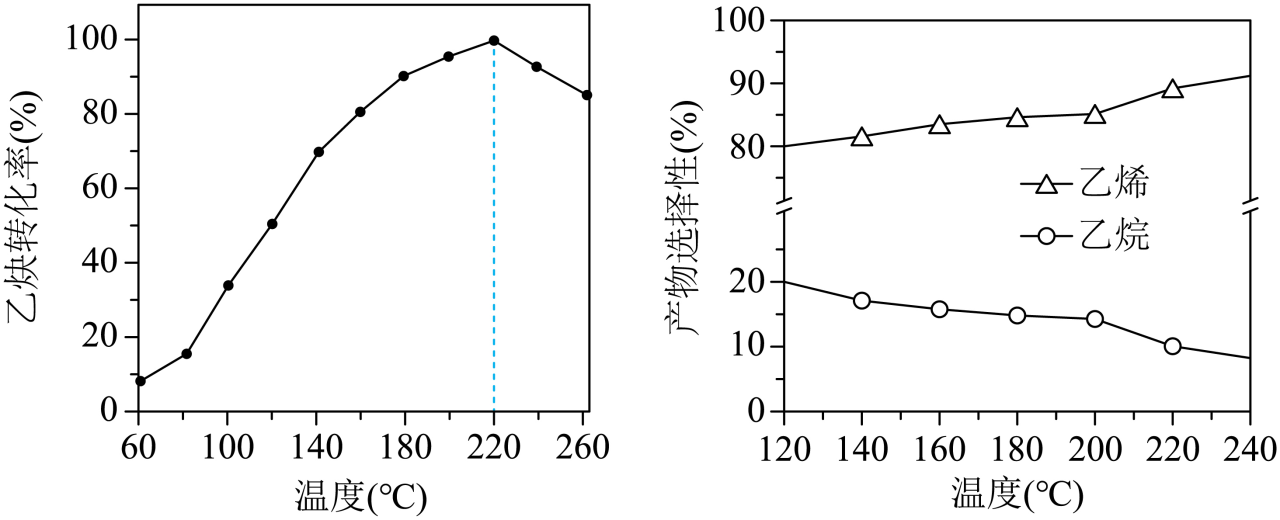
①在$60\sim220\;^\circ \rm C $范围内,乙炔转化率随温度升高而增大的原因为 $\rm ($任写一条$\rm )$,当温度由$\rm 220\;\rm ^\circ\rm C$升高至$\rm 260\;\rm ^\circ\rm C$,乙炔转化率减小的原因可能为 。
②在$\rm 120\sim 240\;\rm ^\circ\rm C$范围内,反应$\rm 1$和反应$\rm 2$乙炔的转化速率大小关系为${{v}_{1}}$ ${{v}_{2}}\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$,理由为 。
温度升高,反应速率加快或温度升高,催化剂活性增强 催化剂在该温度范围内失活;$\\rm \\gt $;乙烯的选择性大于乙烷,说明反应$\\rm 1$乙炔的转化速率大于反应$\\rm 2$乙炔的转化速率
"]]反应未达到平衡状态,温度升高,反应速率加快,乙炔的转化率增大或温度升高,催化剂活性增强,乙炔的转化率增大;
$\rm 220\;\rm ^\circ\rm C-260\;\rm ^\circ\rm C$,乙炔的转化率下降,反应未达平衡状态,说明不是由于平衡移动造成的,可能原因是催化剂在该温度范围内失活;
由图像可知,乙烯的选择性大于乙烷,说明反应$\rm 1$乙炔的转化速率大于反应$\rm 2$乙炔的转化速率,即${{ {v}}_{1}}\gt {{ {v}}_{2}}$;
对于反应$\rm 1$,反应速率${v}\left(\rm {{{C}}_{2}}{{{H}}_{2}} \right)$与$\rm {{{H}}_{2}}$浓度${c}\left(\rm {{{H}}_{2}} \right)$的关系可用方程式${v}\left(\rm {{{C}}_{2}}{{{H}}_{2}} \right)={k}{{\left[ {c}\left(\rm {{{H}}_{2}} \right) \right]}^{\alpha }}$表示$ (k$为常数$\rm )$。$145\;^\circ \rm C $时,保持其他条件不变,测定了不同浓度时的反应速率$\rm ($如下表$\rm )$。当${v}\left(\rm {{{C}}_{2}}{{{H}}_{2}} \right)=1.012\times {{10}^{-4}}\;\rm {mol}\cdot {{{L}}^{-1}}\cdot {{{s}}^{-1}}$时,${c}\left(\rm {{{H}}_{2}} \right)=$ $\mathrm{mol} \cdot \mathrm{L}^{-1}$。
实验组 | ${c}\left(\rm {{{H}}_{2}} \right)/\rm{mol}\cdot {{{L}}^{-1}}$ | ${v}\left(\rm {{{C}}_{2}}{{{H}}_{2}} \right)/\rm{mol}\cdot {{{L}}^{-1}}\cdot {{{s}}^{-1}}$ |
一 | $4.60\times {{10}^{-3}}$ | $5.06\times {{10}^{-5}}$ |
二 | $1.380\times {{10}^{-2}}$ | $1.518\times {{10}^{-4}}$ |
$\\rm 9.2\\times 10^{-3}$
"]]将数据代入方程$\begin{cases} ①5.06\times {{10}^{-5}}={k}\times {{\left(\rm 4.6\times {{10}^{-3}} \right)}^{\alpha}} \\② 1.518\times {{10}^{-4}}={k}\times {{\left(\rm 1.38\times {{10}^{-2}} \right)}^{\alpha}} \\ \end{cases}$,②$\rm \div $①得到$\alpha =1$,则${k}=1.1\times {{10}^{-2}}$,$v\left(\rm {{{C}}_{2}}{{{H}}_{2}} \right)=1.012\times {{10}^{-4}}$时,$1.012\times {{10}^{-4}}=1.1\times {{10}^{-2}}\times {c}\left(\rm {{{H}}_{2}} \right)$,${c}\left(\rm {{{H}}_{2}} \right)=9.2\times {{10}^{-3}}\;\rm {mol}/{L}$;
以$\rm Pd/W$或$\rm Pd$为催化剂,可在常温常压$\left( 25\;^\circ \rm C \text{,}101\;\rm \text{kPa} \right)$下实现乙炔加氢,反应机理如下图所示$\rm ($虚线为生成乙烷的路径$\rm )$。以 为催化剂时,乙烯的选择性更高,原因为 。$\rm ($图中“*”表示吸附态;数值为生成相应过渡态的活化能$\rm )$
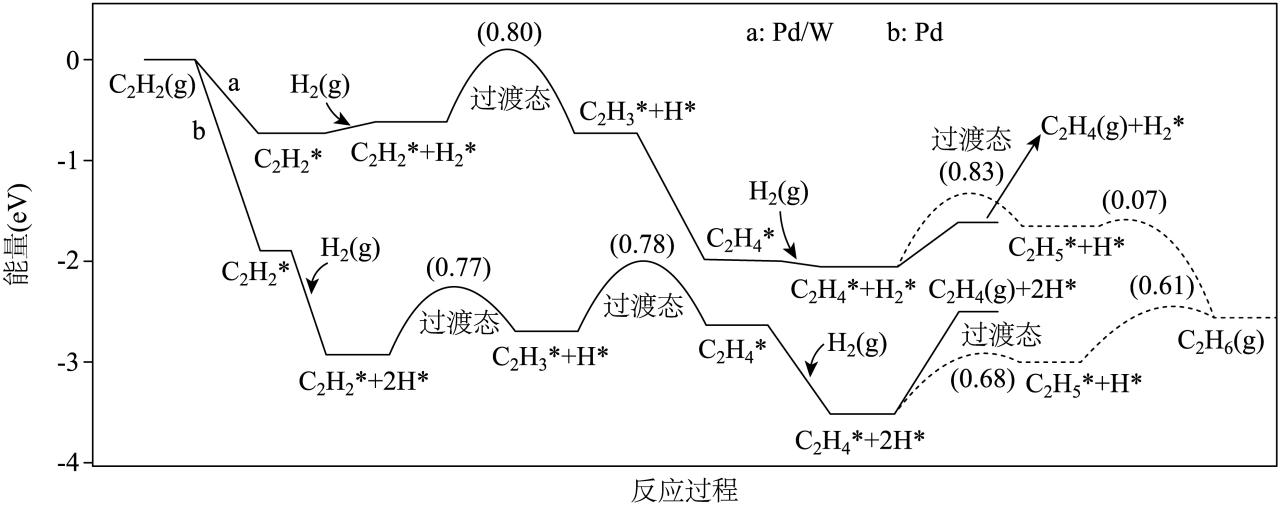
$\\rm Pd/W$;$\\rm Pd/W$做催化剂时,生成乙烷的活化能大于$\\rm Pd$催化剂时的
"]]如图可知,选择$\rm Pd$做催化剂时,生成乙烷的活化能低于选择$\rm Pd/W$时的$\rm (0.68\lt 0.83)$,说明使用$\rm Pd$做催化剂,乙烯更容易转化为乙烷,使乙烯的选择性更小,故$\rm Pd/W$做催化剂时,乙烯的选择性更高。
| 盖斯定律题目答案及解析(完整版)
