| 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
| 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
某兴趣小组为探究$\text{FeS}{{\text{O}}_{\text{4}}}$溶液的化学性质,设计如下实验:
实验Ⅰ:常温下,向新制的$\text{FeS}{{\text{O}}_{\text{4}}}$溶液$\rm ($未酸化$\rm )$中不断通入${{\text{O}}_{\text{2}}}$,溶液逐渐变浑浊,产生红褐色沉淀。
实验Ⅱ:向含少量$\text{NaOH}$的$\text{NaClO}$溶液中逐滴加入$\text{FeS}{{\text{O}}_{\text{4}}}$溶液,并用$\text{pH}$传感器测得滴加过程中溶液的$\text{pH}$变化如下图。
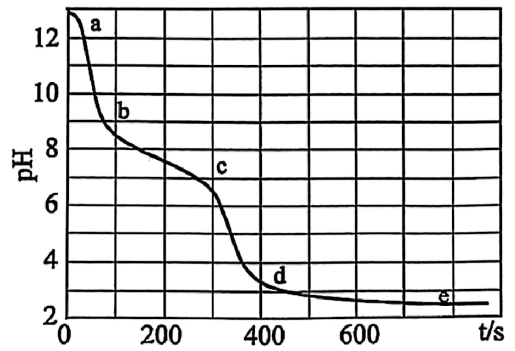
下列说法不正确的是$(\quad\ \ \ \ )$
实验Ⅰ产生红褐色沉淀的过程中溶液酸性在增强
","实验Ⅰ说明$\\text{FeS}{{\\text{O}}_{\\text{4}}}$在酸性或碱性条件下均能被${{\\text{O}}_{\\text{2}}}$氧化
","实验Ⅱ的$\\rm de$段可能会产生黄绿色的气体
","实验Ⅱ的$\\rm bc$段发生的主要反应是$\\text{2F}{{\\text{e}}^{\\text{2}+}}+5\\text{Cl}{{\\text{O}}^{-}}+5{{\\text{H}}_{\\text{2}}}\\text{O}=\\text{2Fe}{{\\left( \\text{OH} \\right)}_{\\text{3}}}\\downarrow +\\text{C}{{\\text{l}}^{-}}+4\\text{HClO}$
"]常温下,向新制的$\text{FeS}{{\text{O}}_{\text{4}}}$溶液$\rm ($未酸化$\rm )$中不断通入${{\text{O}}_{\text{2}}}$,溶液逐渐变浑浊,产生红褐色沉淀,则亚铁离子被氧气氧化为氢氧化铁沉淀,反应为:$\text{4FeS}{{\text{O}}_{\text{4}}}+{{\text{O}}_{\text{2}}}\text{+10}{{\text{H}}_{\text{2}}}\text{O=4Fe}{{\left( \text{OH} \right)}_{\text{3}}}\downarrow \text{+4}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{4}}$;
$\rm A$.由分析可知,实验Ⅰ中同时生成硫酸,则反应后溶液酸性增强,$\rm A$正确;
$\rm B$.实验Ⅰ是在未酸化条件下进行的,则不能说明$\text{FeS}{{\text{O}}_{\text{4}}}$在酸性或碱性条件下均能被${{\text{O}}_{\text{2}}}$氧化,$\rm B$错误;
$\rm C$.实验Ⅱ中亚铁离子被氧化为铁离子,同时次氯酸根离子被还原为氯离子,$\rm de$段的溶液酸性较强,则酸性条件下,氯离子和次氯酸根离子可能会发生归中反应产生黄绿色的气体氯气,$\rm C$正确;
$\rm D$.实验Ⅱ的$\rm bc$段溶液由弱碱性变为弱酸性,则发生的主要反应是亚铁离子被次氯酸根离子氧化为氢氧化铁沉淀、次氯酸根离子被还原为氯离子,同时生成的氢离子和次氯酸根离子结合为弱酸次氯酸,反应为$\text{2F}{{\text{e}}^{\text{2}+}}+5\text{Cl}{{\text{O}}^{-}}+5{{\text{H}}_{\text{2}}}\text{O}=\text{2Fe}{{\left( \text{OH} \right)}_{\text{3}}}\downarrow +\text{C}{{\text{l}}^{-}}+4\text{HClO}$,$\rm D$正确;
故选:$\rm B$
| 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
