| 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
| 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
铜及其化合物在生产、生活中有着广泛应用。请回答:
相关铜元素的描述,下列说法不正确的是 。
$\rm A$.铜元素属于$\rm d$区元素 $\rm B$.水溶液中的$\rm \text{C}{{\text{u}}^{+}}$稳定性弱于$\rm \text{C}{{\text{u}}^{\text{2+}}}$
$\rm C$.$\rm \text{C}{{\text{u}}^{3+}}$的半径大于$\rm \text{C}{{\text{u}}^{+}}$的半径 $\rm D$.基态$\rm Cu$原子的$\rm K$、$\rm L$、$\rm M$能层上电子均已填满
$\\rm AC$
"]]$\rm A$.铜元素是第$\rm 29$号元素,属于$\rm d$区元素,$\rm A$错误;
$\rm B$.$\rm Cu^{+}$在水溶液中容易发生歧化反应,生成$\rm Cu^{2+}$和单质铜,$\rm B$正确;
$\rm C$.$\rm \text{C}{{\text{u}}^{3+}}$的核外电子数小于$\rm \text{C}{{\text{u}}^{+}}$,故$\rm \text{C}{{\text{u}}^{3+}}$的半径小于$\rm \text{C}{{\text{u}}^{+}}$的半径,$\rm C$错误;
$\rm D$.基态$\rm Cu$原子的核外电子排布$\rm [Ar]3d^{10}4s^{1}$,$\rm K$、$\rm L$、$\rm M$能层上电子均已填满,$\rm D$正确;
故选:$\rm AC$;
某含铜化合物可作半导体,其晶胞如图。
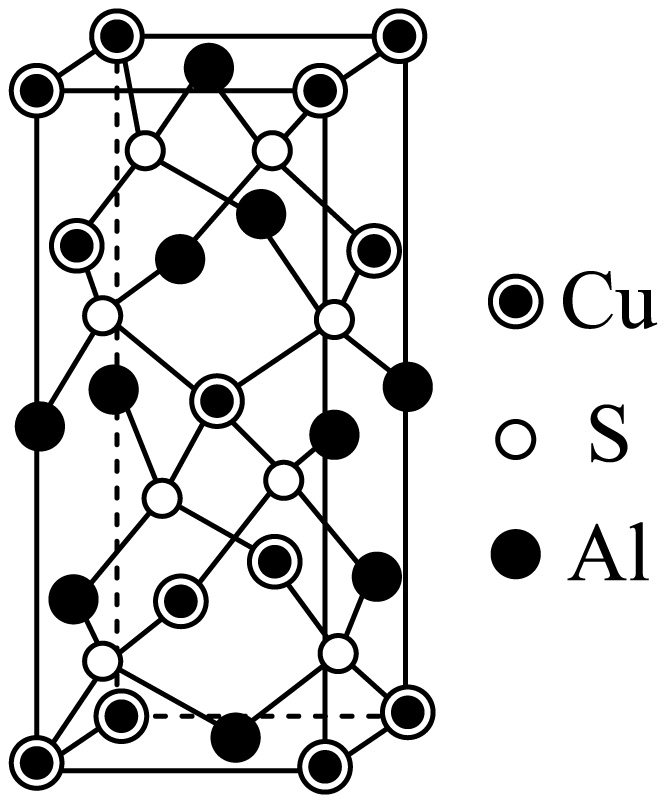
①化学式是 。
②若该晶胞的体积为$V\text{ p}{{\text{m}}^{\text{3}}}$,晶体密度为$\rho \text{ g}\cdot \text{c}{{\text{m}}^{-3}}$,则阿伏伽德罗常数${{N}_{\text{A}}}=$ $\text{mo}{{\text{l}}^{-1}}$。
③少量该化合物溶于$\text{0}\text{.1 mol}\cdot {{\text{L}}^{-1}}\text{ HF}$,能明显增强$\rm HF$溶液酸性,原因是 $\rm [$已知${{K}_{\text{a}}}\left( \text{HF} \right)=6.3\times {{10}^{-4}}\rm ]$。
$\\text{CuAl}{{\\text{S}}_{\\text{2}}}$ ; $\\dfrac{6.2\\times {{10}^{32}}}{\\rho V}$ ; ${{\\text{F}}^{-}}$能与$\\text{A}{{\\text{l}}^{\\text{3}}}^{+}$等形成配离子,从而促进$\\rm HF$的电离
"]]①根据均摊法,$\rm Cu$数目$8\times \dfrac{1}{8}+4\times \dfrac{1}{2}+1=4$,$\rm S$数目$\rm 8$,$\rm Al$数目$4 \times \dfrac{1}{4}+6 \times \dfrac{1}{2}=4$,化学式是$\text{CuAl}{{\text{S}}_{\text{2}}}$;
②$\rho =\dfrac{4\times \left( 64+2\times 32+27 \right)}{{{N}_{\text{A}}}V\times \text{1}{{\text{0}}^{\text{-30}}}}\Rightarrow {{N}_{\text{A}}}=\dfrac{6.2\times {{10}^{32}}}{\rho V}$;
③少量该化合物溶于$\text{0}\text{.1 mol}\cdot {{\text{L}}^{-1}}\text{ HF}$中存在电离平衡$\text{HF}\rightleftharpoons {{\text{H}}^{+}}+{{\text{F}}^{-}}$,${{\text{F}}^{-}}$能与$\text{A}{{\text{l}}^{\text{3+}}}$等形成配离子,从而促进$\rm HF$的电离,使氢离子浓度增高,$\rm HF$溶液酸性增强;
兴趣小组对某铜铅灰$\rm ($主要成分为$\text{C}{{\text{u}}_{\text{2}}}\text{O}、\text{Pb}{{\text{O}}_{\text{2}}}、\text{PbO}$及其硫酸盐$\rm )$进行资源回收利用,设计了以下流程:

①溶液$\rm A$是 ,操作$\rm B$是 ,操作$\rm E$是 。
②“充分反应”过程涉及的氧化还原反应的化学方程式是 。
③溶液$\rm D$中通入$\text{S}{{\text{O}}_{\text{2}}}$,可生成$\text{N}{{\text{H}}_{\text{4}}}\text{CuS}{{\text{O}}_{\text{3}}}$沉淀,该转化反应中$\text{S}{{\text{O}}_{\text{2}}}$体现的性质是 。
${{\\text{H}}_{\\text{2}}}\\text{S}{{\\text{O}}_{\\text{4}}}$ ; 过滤 ; 结晶、过滤、洗涤、干燥 ; $\\text{C}{{\\text{u}}_{\\text{2}}}\\text{O}+\\text{Pb}{{\\text{O}}_{2}}+3{{\\text{H}}_{\\text{2}}}\\text{S}{{\\text{O}}_{\\text{4}}}=\\text{PbS}{{\\text{O}}_{\\text{4}}}+\\text{2CuS}{{\\text{O}}_{\\text{4}}}+3{{\\text{H}}_{\\text{2}}}\\text{O}$ ; 还原性和酸性
"]]烟铅灰和硫酸以及空气发生的反应分别为:$\rm CuO+H_{2}SO_{4}=CuSO_{4}+H_{2}O$、$\rm PbO+H_{2}SO_{4}=PbSO_{4}↓+H_{2}O$、$\text{C}{{\text{u}}_{\text{2}}}\text{O}+\text{Pb}{{\text{O}}_{2}}+3{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}=\text{PbS}{{\text{O}}_{\text{4}}}+\text{2CuS}{{\text{O}}_{\text{4}}}+3{{\text{H}}_{\text{2}}}\text{O}$,过滤后会得到硫酸铅沉淀,通入足量$\rm NH_{3}$,经结晶、过滤、洗涤、干燥得到$[\!\!\text{ Cu(N}{{\text{H}}_{\text{3}}}{{\text{)}}_{\text{4}}}]\!\!\text{ S}{{\text{O}}_{\text{4}}}\cdot x{{\text{H}}_{\text{2}}}\text{O}$;
①根据分析可知,溶液$\rm A$是${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$;,操作$\rm B$是过滤,操作$\rm E$是结晶、过滤、洗涤、干燥;
②根据分析可知,“充分反应”过程涉及的氧化还原反应的化学方程式是$\text{C}{{\text{u}}_{\text{2}}}\text{O}+\text{Pb}{{\text{O}}_{2}}+3{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}=\text{PbS}{{\text{O}}_{\text{4}}}+\text{2CuS}{{\text{O}}_{\text{4}}}+3{{\text{H}}_{\text{2}}}\text{O}$;
③溶液$\rm D$中通入$\text{S}{{\text{O}}_{\text{2}}}$,可生成$\text{N}{{\text{H}}_{\text{4}}}\text{CuS}{{\text{O}}_{\text{3}}}$沉淀,该转化反应中铜化合价降低,同时生成亚硫酸盐,$\text{S}{{\text{O}}_{\text{2}}}$体现的性质是还原性和酸性。
| 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
