高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
钼钢具有高强度、高韧性、耐腐蚀等优良性能。一种利用钼渣$\rm [$含$\text{CaMo}{{\text{O}}_{4}}$、$\text{F}{{\text{e}}_{2}}{{\left( \text{Mo}{{\text{O}}_{4}} \right)}_{3}}$、$\text{PbMo}{{\text{O}}_{4}}$、$\text{Mo}{{\text{S}}_{2}}\rm ]$制备钼酸铵的流程如图所示:
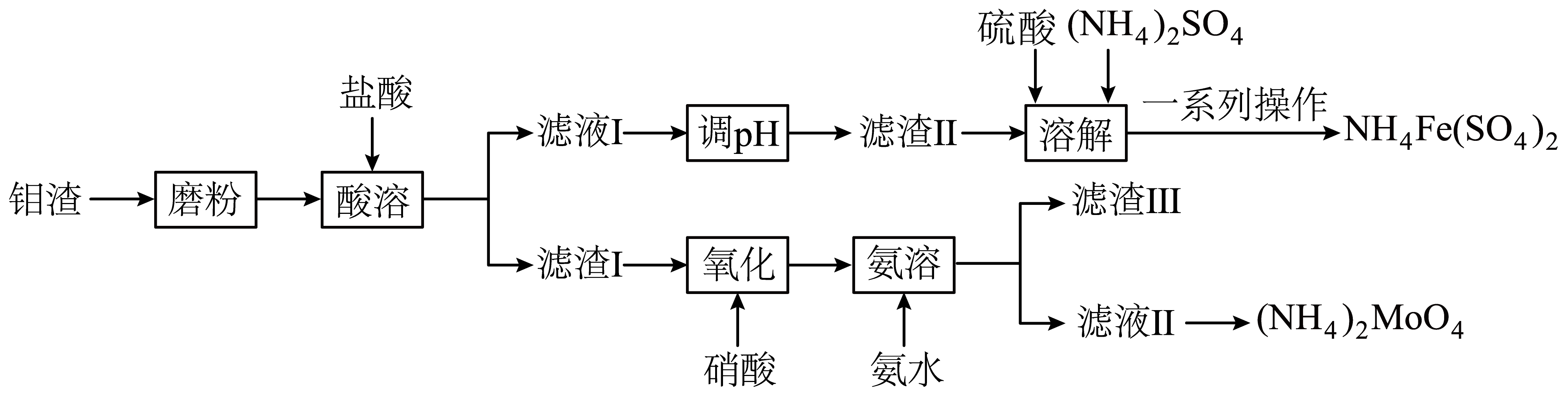
已知:①钼酸$\rm (\mathrm{H}_{2} \mathrm{MoO}_{4}\rm )$不溶于水;②当溶液中某离子浓度$c\left( {{\text{M}}^{n+}} \right)\le 1\times {{10}^{-5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$时,可认为该离子沉淀完全;常温下,几种沉淀的${{K}_{\text{sp}}}$如下表所示:
| $\text{Fe}{{(\text{OH})}_{3}}$ | $\text{PbC}{{\text{l}}_{2}}$ | $\text{PbS}{{\text{O}}_{4}}$ | $\text{Fe}{{(\text{OH})}_{2}}$ | |
| ${{K}_{\text{sp}}}$ | $1\times {{10}^{-38}}$ | $1\times {{10}^{-5}}$ | $1\times {{10}^{-8}}$ | $5\times {{10}^{-17}}$ |
回答下列问题:
“磨粉”操作的目的是 ,实验室模拟该操作所需主要仪器是 。
增大固体与盐酸的接触面积,加快反应速率,充分反应 ; 研钵
"]]根据影响反应速率的因素,增大接触面积,能加快反应速率,“磨粉”操作的目的是增大固体与盐酸的接触面积,加快反应速率,充分反应;实验室中“磨粉”操作在研钵中进行。
“调$\text{pH}$”可加入$\text{CaC}{{\text{O}}_{3}}$,生成“滤渣$\text{II}$”的离子方程式为 ,向“滤渣$\text{II}$”加入硫酸和${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{S}{{\text{O}}_{4}}$溶解,再经一系列操作可得到$\text{N}{{\text{H}}_{4}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}$,则理论上加入$\textit{n}\left( \text{H}_{\text{2}}\text{S}\text{O}_{\text{4}}\right):\textit{n}\left[ \left( \text{N}\text{H}_{\text{4}}\right)_{\text{2}}\text{S}\text{O}_{\text{4}}\right]=$ 。
${2 \\mathrm{Fe}^{3+}+3 \\mathrm{CaCO}_{3}+3 \\mathrm{H}_{2} \\mathrm{O}=2 \\mathrm{Fe}(\\mathrm{OH})_{3}+3 \\mathrm{Ca}^{2+}+3 \\mathrm{CO}_{2} }$ ; $\\rm 3$∶$\\rm 1$
"]]根据流程图,可知加入碳酸钙“调$\text{pH}$”生成“滤渣$\text{II}$”是氢氧化铁,反应的离子方程式为${2 \mathrm{Fe}^{3+}+3 \mathrm{CaCO}_{3}+3 \mathrm{H}_{2} \mathrm{O}=2 \mathrm{Fe}(\mathrm{OH})_{3}+3 \mathrm{Ca}^{2+}+3 \mathrm{CO}_{2} }$;${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}\text{S}{{\text{O}}_{4}}$中$\textit{n}\left( \text{NH}_{4}^{+}\right):\textit{n}\left( \text{SO}_{4}^{2-}\right)=2:1$ ,$\text{N}{{\text{H}}_{4}}\text{Fe}{{\left( \text{S}{{\text{O}}_{4}} \right)}_{2}}$中$\textit{n}\left( \text{NH}_{4}^{+}\right):\textit{n}\left( \text{SO}_{4}^{2-}\right)=2:4$,则理论上加入${n\left(\mathrm{H}_{2} \mathrm{SO}_{4}\right): n\left[\left(\mathrm{NH}_{4}\right)_{2} \mathrm{SO}_{4}\right]=}=\rm 3:1$。
稀硝酸氧化时将$\text{Mo}{{\text{S}}_{2}}$转化为$\mathrm{H}_{2} \mathrm{MoO}_{4}$和${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$,该反应的离子方程式为 ,“滤渣$\text{III}$”的主要成分为 。
$\\text{Mo}{{\\text{S}}_{2}}+6\\text{NO}_{3}^{-}+2{{\\text{H}}^{+}}={{\\text{H}}_{2}}\\text{Mo}{{\\text{O}}_{4}}+2\\text{SO}_{4}^{2-}+6\\text{NO}$ ; $\\text{PbS}{{\\text{O}}_{4}}$
"]]稀硝酸氧化时将$\text{Mo}{{\text{S}}_{2}}$转化为$\mathrm{H}_{2} \mathrm{MoO}_{4}$和${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$,硝酸被还原为一氧化氮,根据得失电子守恒,该反应的离子方程式为$\text{Mo}{{\text{S}}_{2}}+6\text{NO}_{3}^{-}+2{{\text{H}}^{+}}={{\text{H}}_{2}}\text{Mo}{{\text{O}}_{4}}+2\text{SO}_{4}^{2-}+6\text{NO}$,“滤渣$\rm 1$”中的$\rm PbCl_{2}$和$\text{Mo}{{\text{S}}_{2}}$氧化生成的硫酸反应生成$\rm PbSO_{4}$沉淀,所以“滤渣$\text{III}$”的主要成分为$\rm PbSO_{4}$。
钼酸钠和月桂酰肌氨酸常用做碳钢的缓蚀剂。
①空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成$\text{FeMo}{{\text{O}}_{4}}-\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是 $\rm ($填字母$\rm )$。
$\rm A$.适量的${{\text{N}}_{2}}$ $\rm B$.$\text{NaN}{{\text{O}}_{2}}$ $\rm C$.油脂 $\rm D$.盐酸
②常温下,碳钢在不同介质中腐蚀速率的实验结果如图所示。
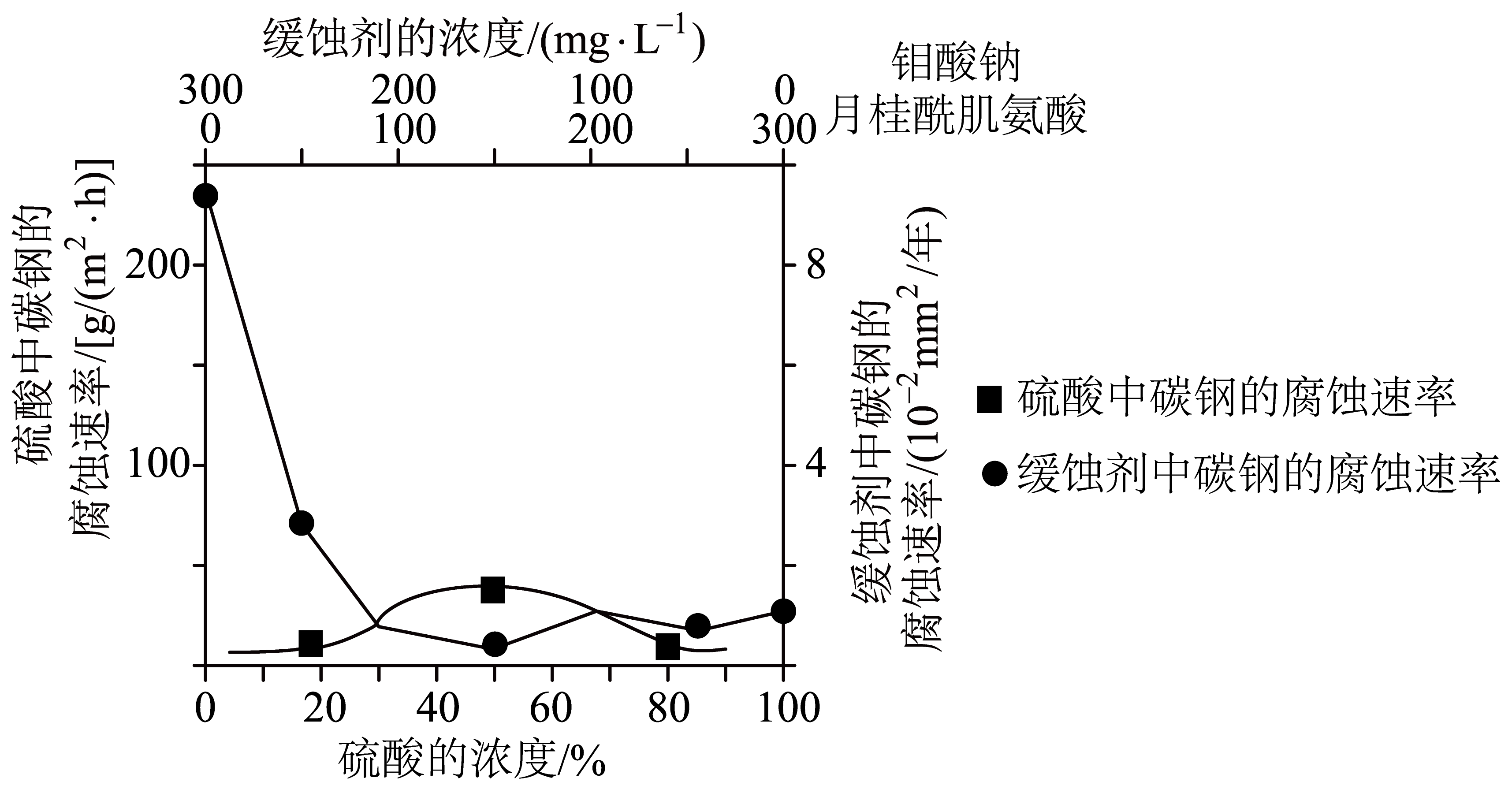
当硫酸的浓度大于$90\%$时,腐蚀速率几乎为零,原因是 。若缓蚀剂为钼酸钠$\rm —$月桂酰肌氨酸$\rm ($总浓度为$300\ \text{mg}\cdot {{\text{L}}^{-1}}\rm )$,缓蚀效果最好时,钼酸钠$({\mathrm{\textit{M}}=206 \ \mathrm{g} \cdot \mathrm{mol}^{-1}}\rm )$的物质的量浓度为 $\mathrm{mol} \cdot \mathrm{L}^{-1}\rm ($保留$\rm 2$位有效数字$\rm )$。
$\\text{B}$ ; 常温下浓硫酸会使铁钝化 ; $7.3\\times {{10}^{-4}}$
"]]①$\rm NaNO_{2}$的具有氧化性, $\rm NaNO_{2}$可以替代空气中氧气起氧化剂作用,有利于在钢铁表面形成$\rm FeMoO_{4}-Fe_{2}O_{3}$保护膜,所以密闭式循环冷却水系统中的碳钢管道缓蚀,除加入钼酸盐外还需加入的物质是$\text{NaN}{{\text{O}}_{2}}$,选$\rm B$。
②常温下浓硫酸会使铁钝化,所以当硫酸的浓度大于$90\%$时,腐蚀速率几乎为零。缓蚀效果最好时,钼酸钠的浓度为$\text{150\;\rm mg}\cdot {{\text{L}}^{-1}}$ ,钼酸钠的物质的量浓度为$\dfrac{\dfrac{\text{0}\text{.15\ g}}{\text{206\ g/mol}}}{1\ \text{L}}=7.3\times10^{-4}$ $\mathrm{mol} \cdot \mathrm{L}^{-1}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
