高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
糖精钠是一种甜味剂。某实验小组在实验室利用甲苯氯磺化法按一下五个步骤制备糖精钠$\rm ($部分操作及反应条件略$\rm )$。
步骤$\rm I$:氯磺化
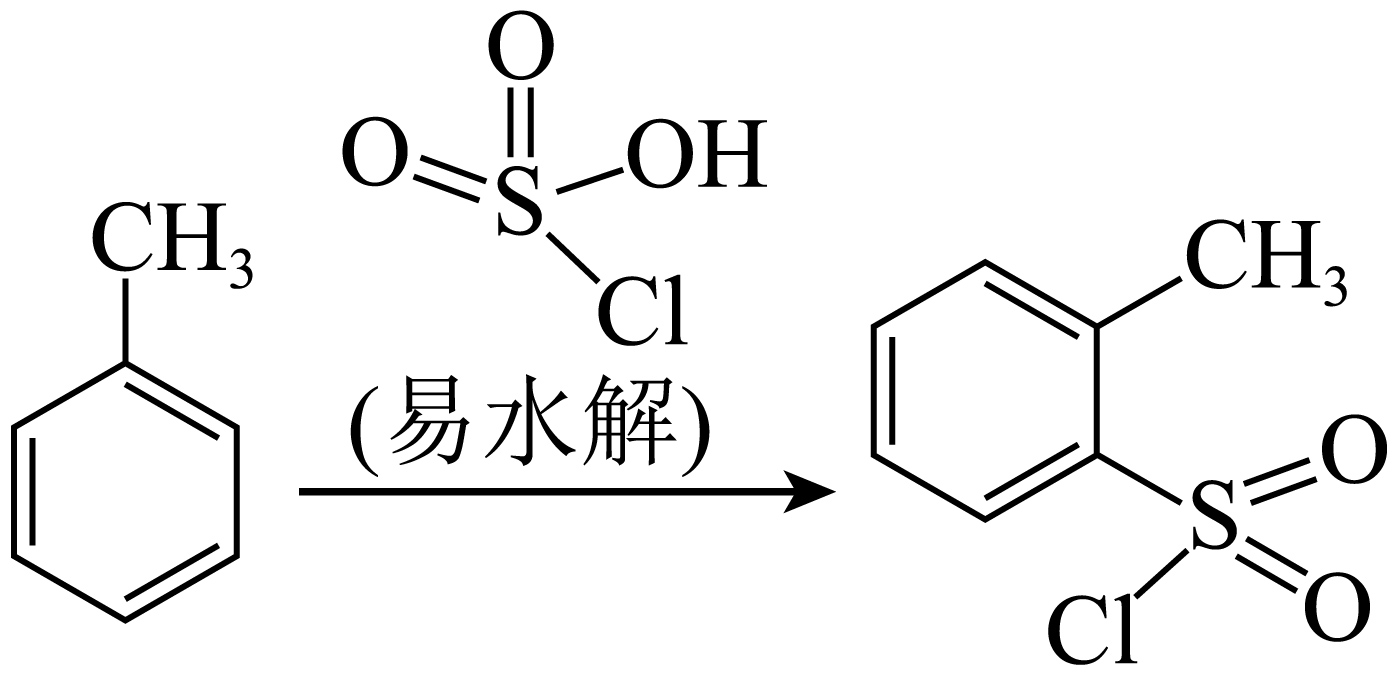
实验装置示意图如图所示$\rm ($夹持及控温装置略$\rm )$。
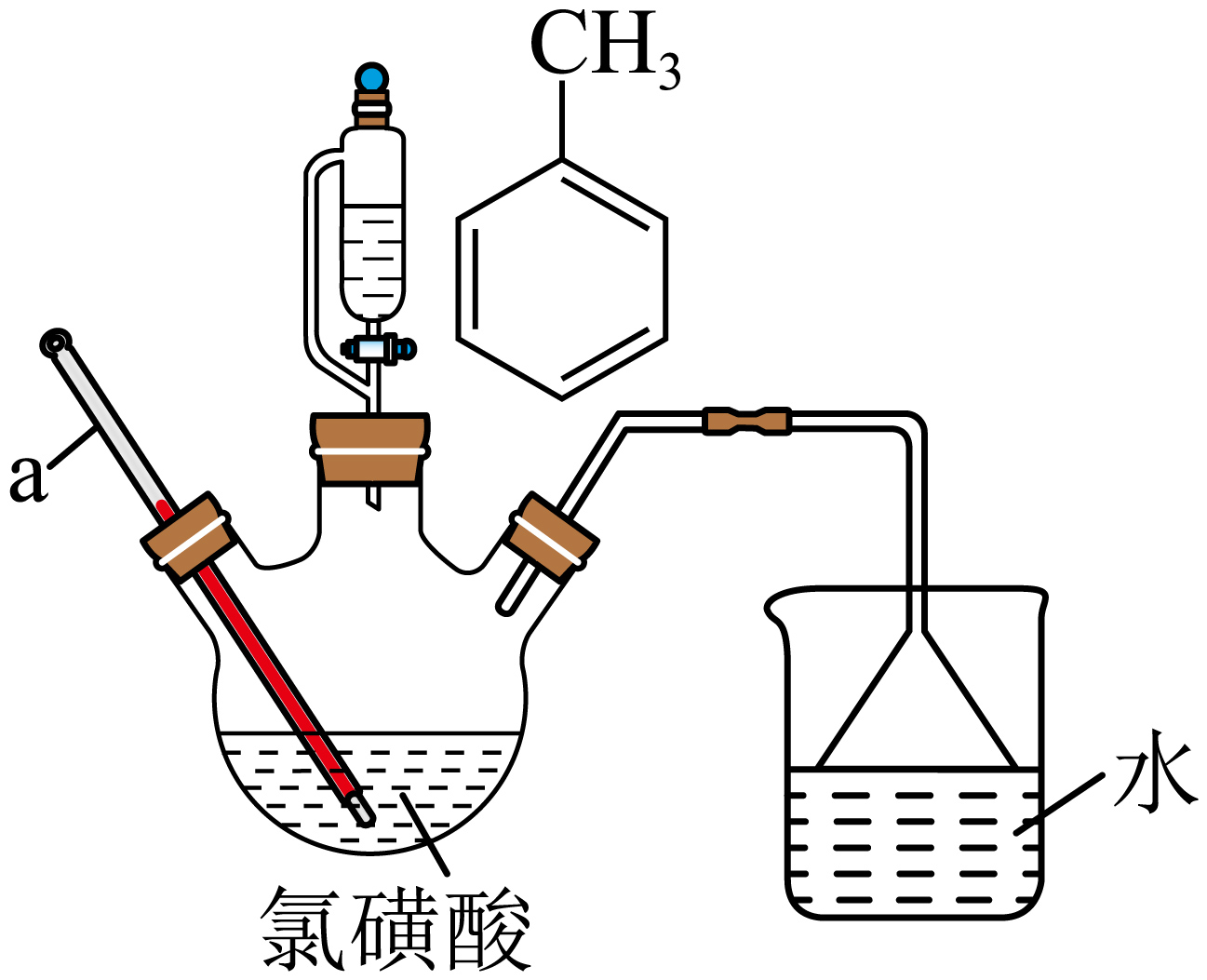
①仪器$\rm a$的名称为 。
②烧杯中吸收的尾气是 $\rm ($填化学式$\rm )$。
温度计;$\\rm HCl$
"]]步骤$\rm I$氯磺化的产物易水解,水解生成的氯化氢极易溶于水,可用水来吸收,由装置图可知,$\rm a$为温度计;
步骤$\rm II$:氨化
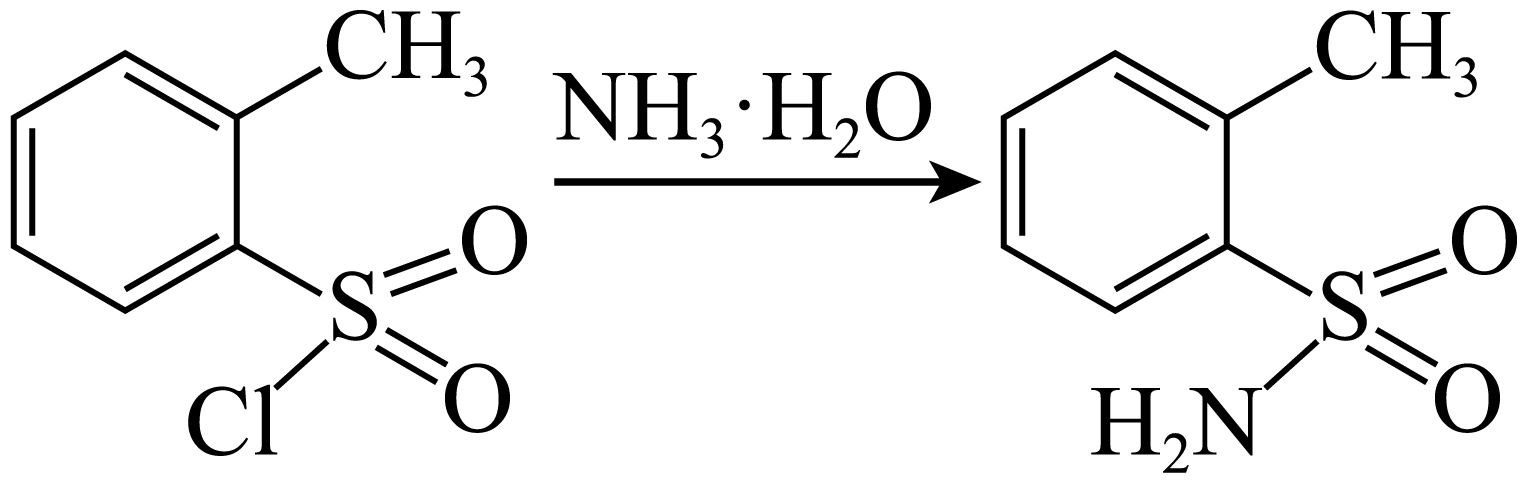
若取邻甲苯磺酰氯$\rm 0.3\;\rm mol$,理论上至少需加入$\rm 15\;\rm mol·L^{-1}$氨水 $\rm \;\rm mL$。
$\\rm 40$
"]]由方程式可知,邻甲基磺酸氯与氨水为$\rm 1:1$进行反应,$\rm 0.3\;\rm mol$邻甲基磺酸氯中消耗的氨水为$\rm 0.3\;\rm mol$,加入$\rm 15\;\rm mol/L$的氨水,充分反应后,消耗$\rm 20$毫升的氨水,同时产生$\rm 0.3\;\rm mol$的氯化氢,氯化氢与氨水中和反应,消耗的氨水为$\rm 0.3\;\rm mol$,即$\rm 20$毫升,所以一共需要消耗$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$的体积为$\rm 40\;\rm mL$;
步骤$\rm III$:氧化
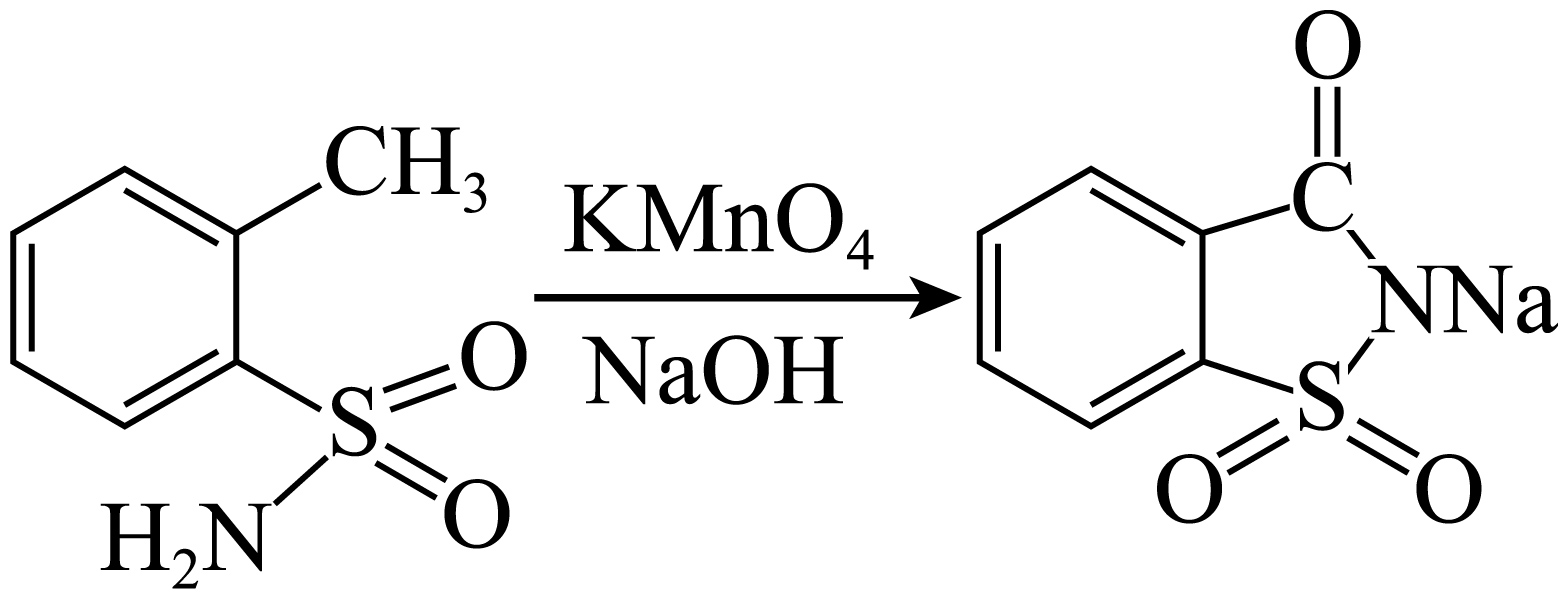
氧化过程中为保证氧化完全,需加入过量的$\rm KMnO_{4}$。反应完成后,向其中滴加$\rm Na_{2}SO_{3}$溶液将过量的$\rm KMnO_{4}$转化成$\rm MnO_{2}$。观察到现象为 时,停止加入$\rm Na_{2}SO_{3}$溶液,其离子方程式为 。
溶液紫色褪去;$\\text{2MnO}_{\\text{4}}^{-}\\text{+3SO}_{\\text{3}}^{\\text{2-}}+{{\\text{H}}_{\\text{2}}}\\text{O=2Mn}{{\\text{O}}_{\\text{2}}}\\text{+3SO}_{\\text{4}}^{\\text{2}}\\text{+2O}{{\\text{H}}^{-}}$
"]]氧化过程中为保证氧化完全,需要加入过量的$\text{KMn}{{\text{O}}_{4}}$,反应完全后,向其中滴加$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}}$以除去过量$\text{KMn}{{\text{O}}_{4}}$溶液,$\text{KMn}{{\text{O}}_{4}}$溶液被消耗,则反应完全的现象是溶液紫色褪去,该溶液为碱性,则$\text{KMn}{{\text{O}}_{4}}$被还原成二氧化锰,根据氧化还原规律,得出离子方程式为:$\text{2MnO}_{\text{4}}^{-}\text{+3SO}_{\text{3}}^{\text{2-}}+{{\text{H}}_{\text{2}}}\text{O=2Mn}{{\text{O}}_{\text{2}}}\text{+3SO}_{\text{4}}^{\text{2}}\text{+2O}{{\text{H}}^{-}}$;
步骤$\rm IV$:酸化
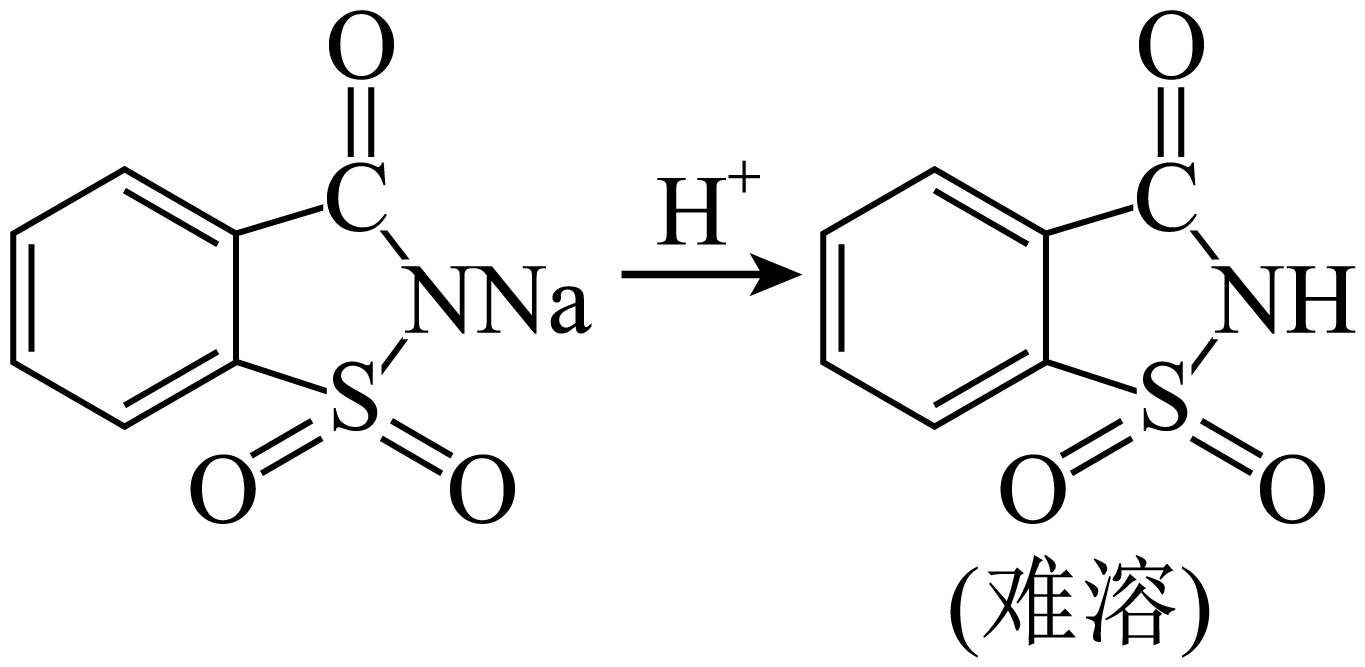
将步骤$\rm III$所得溶液进行酸化,经过滤得糖精。过滤需用到下列的仪器有 。
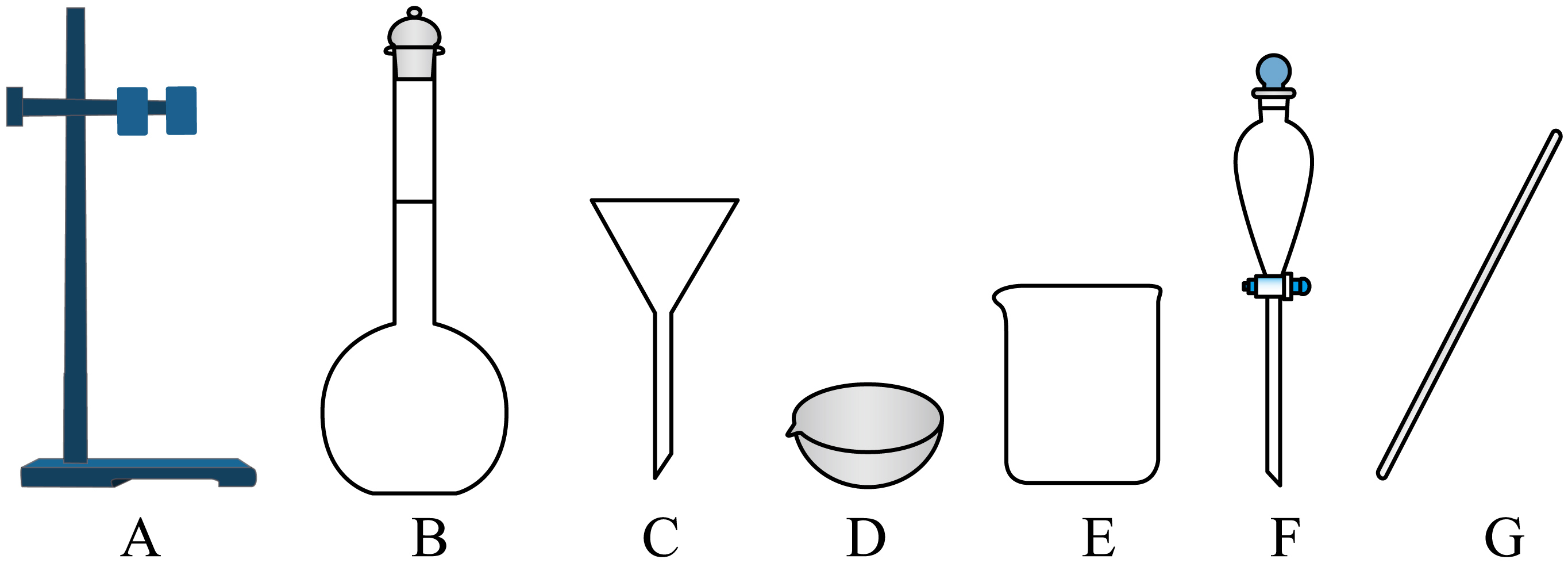
$\\rm ACEG$
"]]过滤需要烧杯,漏斗,玻璃棒,铁架台等,故需要的仪器为:$\rm ACEG$;
步骤$\rm V$:成盐
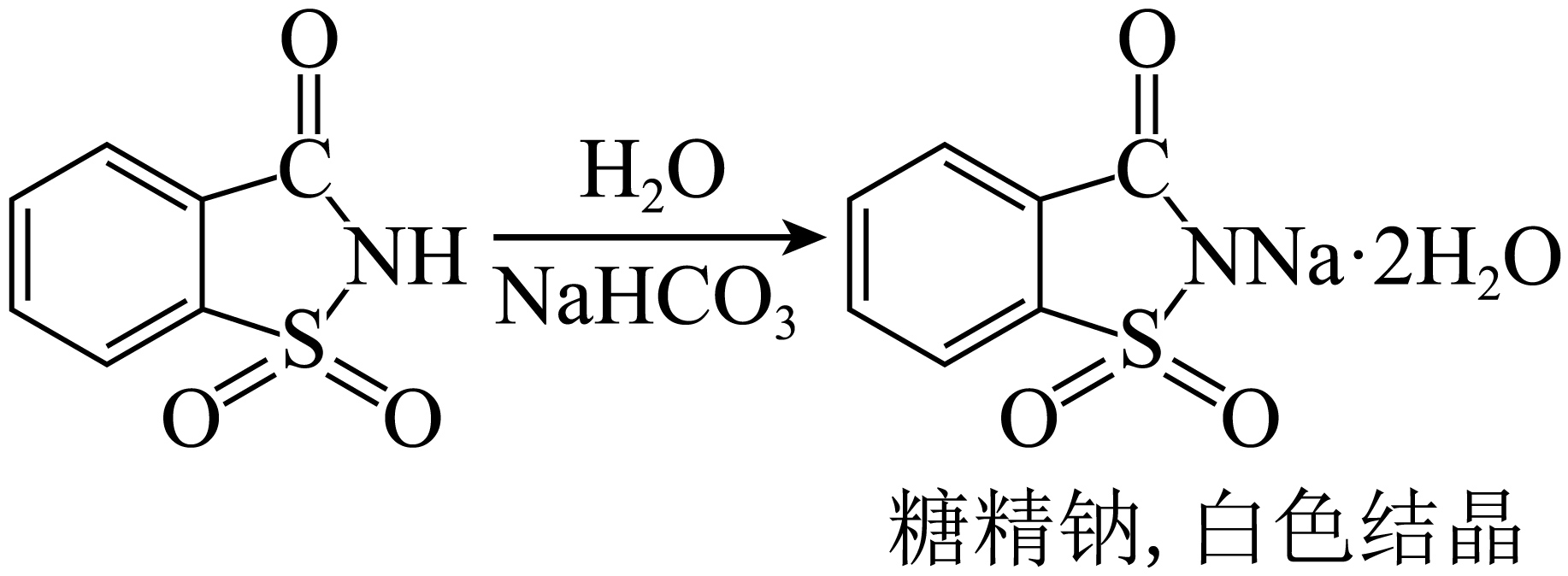
加热反应体系,过程中产生大量气体,该气体为 $\rm ($填化学式$\rm )$。待$\rm NaHCO_3$反应完全,趁热过滤。由滤液获得糖精钠产品的过程中,冷却结晶之后的操作步骤还有 。
$\\text{C}{{\\text{O}}_{2}}$;过滤、洗涤、干燥
"]]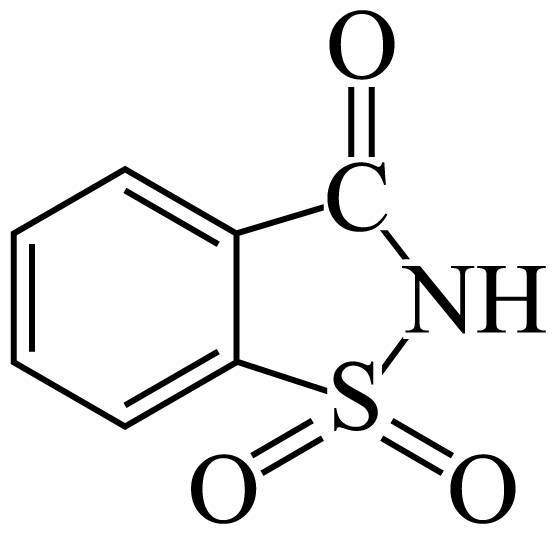 能水解生成羧基,与$\text{NaHC}{{\text{O}}_{3}}$反应,产生大量的二氧化碳气体,当$\text{NaHC}{{\text{O}}_{3}}$完全反应,趁热过滤,冷却结晶的后续操作是过滤,洗涤,干燥。
能水解生成羧基,与$\text{NaHC}{{\text{O}}_{3}}$反应,产生大量的二氧化碳气体,当$\text{NaHC}{{\text{O}}_{3}}$完全反应,趁热过滤,冷却结晶的后续操作是过滤,洗涤,干燥。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
