高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
我国的歼$\rm -20$战机使用了大量的钛金属,四氯化钛是生产海绵钛的重要中间原料,某小组同学利用如下装置在实验室制备$\rm TiCl_{4}($夹持装置略去$\rm )$。
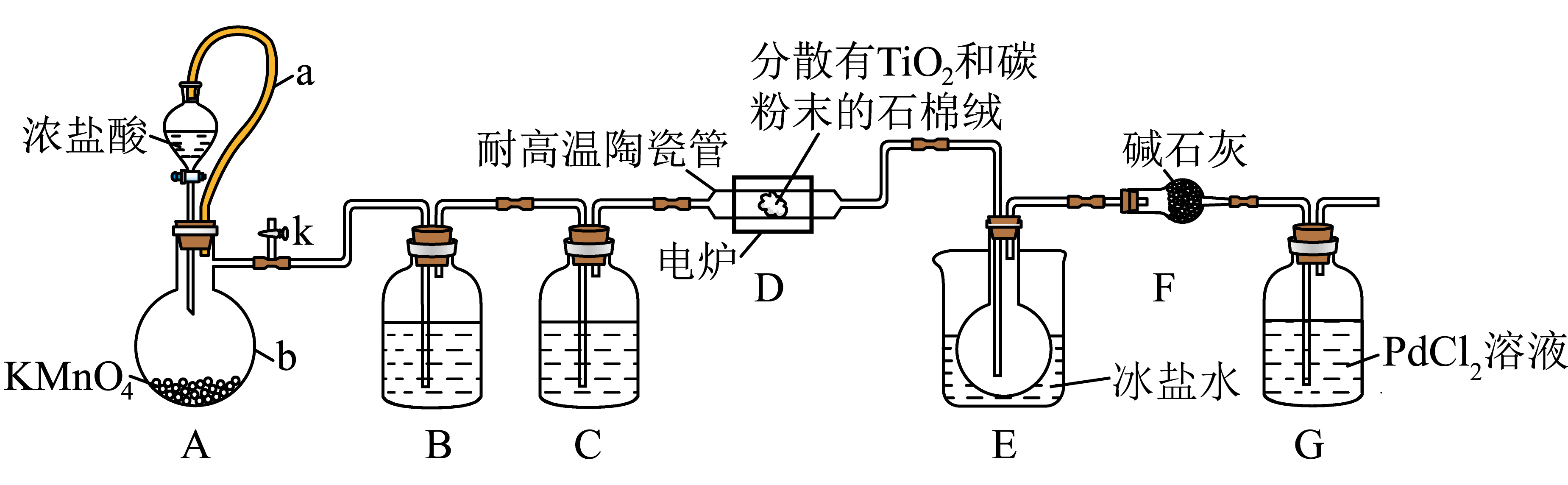
已知:①$\rm CO$与$\rm PdCl_{2}$溶液反应产生黑色金属钯;
②有关物质的性质:
| 熔点$\rm /^\circ\rm C$ | 沸点$\rm /^\circ\rm C$ | 密度$\rm /(g/cm^{3})$ | 水溶性 | |
| $\rm TiCl_{4}$ | $\rm -24$ | $\rm 136.4$ | $\rm 1.7$ | 易水解生成白色沉淀,能溶于有机溶剂 |
| $\rm CCl_{4}$ | $\rm -23$ | $\rm 76.8$ | $\rm 1.6$ | 难溶于水 |
请回答下列问题:
装置$\rm A$中$\rm a$的作用是 ,仪器$\rm b$的名称为 。
平衡气压,使液体顺利流下 ;蒸馏烧瓶
"]]装置$\rm A$中$\rm a$的作用是平衡气压,使液体顺利流下;仪器$\rm b$的名称为蒸馏烧瓶;
装置$\rm C$中的药品为 ,装置$\rm E$用冰盐水浴的目的是 。
浓硫酸; 冷凝收集$\\rm TiCl_{4}$
"]]根据分析,$\rm C$中盛放浓硫酸,干燥氯气;因$\rm TiCl_{4}$的熔点低,用冰盐水浴的目的是冷凝收集$\rm TiCl_{4}$;
组装好仪器后,部分实验步骤如下:①装入药品;②打开分液漏斗活塞;③检查装置气密性;④关闭分液漏斗活塞;⑤停止加热,充分冷却;⑥加热装置$\rm D$中陶瓷管。从上述步骤中选择合适操作$\rm ($不重复使用$\rm )$并排序:③① $\rm ($填序号$\rm )$。
②⑥⑤④
"]]组装好仪器后,部分实验步骤如下③检查装置气密性,①装入药品,②打开分液漏斗活塞,⑥加热装置$\rm D$中陶瓷管,⑤停止加热,充分冷却,④关闭分液漏斗活塞;
装置$\rm D$中发生两个反应,其中副反应为$\rm C+Cl_2\begin{array}{c}\underline{\underline{高温}}\\{}\end{array}CCl_4$,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应化学方程式 。
$\\text{Ti}\\text{O}_{\\text{2}}+2\\text{C}+2\\text{C}\\text{l}_{2}\\begin{array}{c} {\\underline{\\underline{\\triangle}}}\\\\{} \\end{array}\\text{TiC}\\text{l}_{4}+2\\text{CO}$
"]]反应中氧化剂与还原剂的物质的量相等且只有两种产物,反应化学方程式$\text{Ti}\text{O}_{\text{2}}+2\text{C}+2\text{C}\text{l}_{2}\begin{array}{c} {\underline{\underline{\triangle}}}\\{} \end{array}\text{TiC}\text{l}_{4}+2\text{CO}$;
进一步提纯$\rm E$中产物的方法是 。
蒸馏
"]]根据表格信息,$\rm TiCl_{4}$与$\rm CCl_{4}$互溶,但沸点差异比较大,故从混合液体分离出$\rm TiCl_{4}$的操作为蒸馏;
测定$\rm TiCl_{4}$的含量:取$\rm 1.0\;\rm g$产品于烧瓶中,通过安全漏斗加入足量蒸馏水,充分反应后将安全漏斗及烧瓶中的液体转移到容量瓶中配成$\rm 100\;\rm mL$溶液。取$\rm 20.00\;\rm mL$于锥形瓶中,滴加$\rm 2-3$滴$\rm K_{2}CrO_{4}$溶液为指示剂,用$\rm 0.1000\;\rm mol/L$的$\rm AgNO_{3}$标准溶液滴定至终点,消耗溶液$\rm 40.00\;\rm mL$。该产品纯度为 $\rm \%$。下列实验操作会导致产品纯度测定结果偏低的有 。
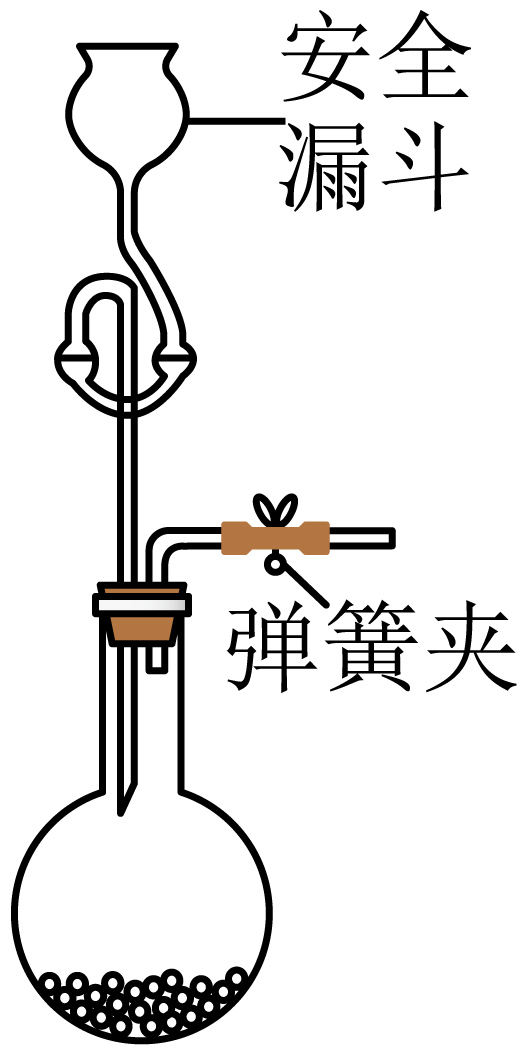
$\rm A$.未用标准液润洗滴定管 $\rm B$.未将安全漏斗中的液体转移到容量瓶中
$\rm C$.滴定终点时仰视读数 $\rm D$.滴加过多的$\rm K_{2}CrO_{4}$溶液
$95.0$; $\\rm BD$
"]]①根据关系式$\rm TiCl_{4}$~$\rm 4HCl$~$\rm 4AgNO_{3}$,$\rm \textit{n}(TiCl_{4})=\dfrac{\text{1}}{\text{4}}\rm (HCl)=\dfrac{\text{1}}{\text{4}}$ $\rm (AgNO_{3})=\dfrac{\text{1}}{\text{4}}\times 40.00\times {{10}^{-3}}\text{L}\times 0.1000\ \text{mol/L}\rm =\text{1}\times {{10}^{-3}}\ \rm mol$,取$\rm 1.0\;\rm g$产品于烧瓶中,配成$\rm 100.00\;\rm mL$溶液,取$\rm \dfrac{\text{1}}{\text{5}}$于锥形瓶中,则产品纯度为$\rm \dfrac{\text{1}\text{0}^{\text{-3}}\times190\text{ g}\times\text{5}}{1\text{ g}}\times100\%=95.0\%$。
②$\rm A$.未用标准液润洗滴定管,消耗的标准液偏多,产品纯度测定结果偏大,$\rm A$错误;
$\rm B$.安全漏斗吸收挥发的$\rm HCl$气体,未将安全漏斗中的液体转移到容量瓶中,产品纯度测定结果偏低,$\rm B$正确;
$\rm C$.滴定终点时仰视读数,标准液体积偏大,产品纯度测定结果偏大,$\rm C$错误;
$\rm D$.滴加过多的 $\rm K_{2}CrO_{4}$溶液会让滴定终点提前,标准液偏少,产品纯度测定结果偏低,$\rm D$正确;
故选:$\rm BD$
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
