高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
以铂钯精矿$\rm ($含$\rm Se$、$\rm Te$、$\rm Au$、$\rm Pt$、$\rm Pd$等$\rm )$为原料,提取贵金属$\rm Au$、$\rm Pt$、$\rm Pd$的工艺流程如图所示:
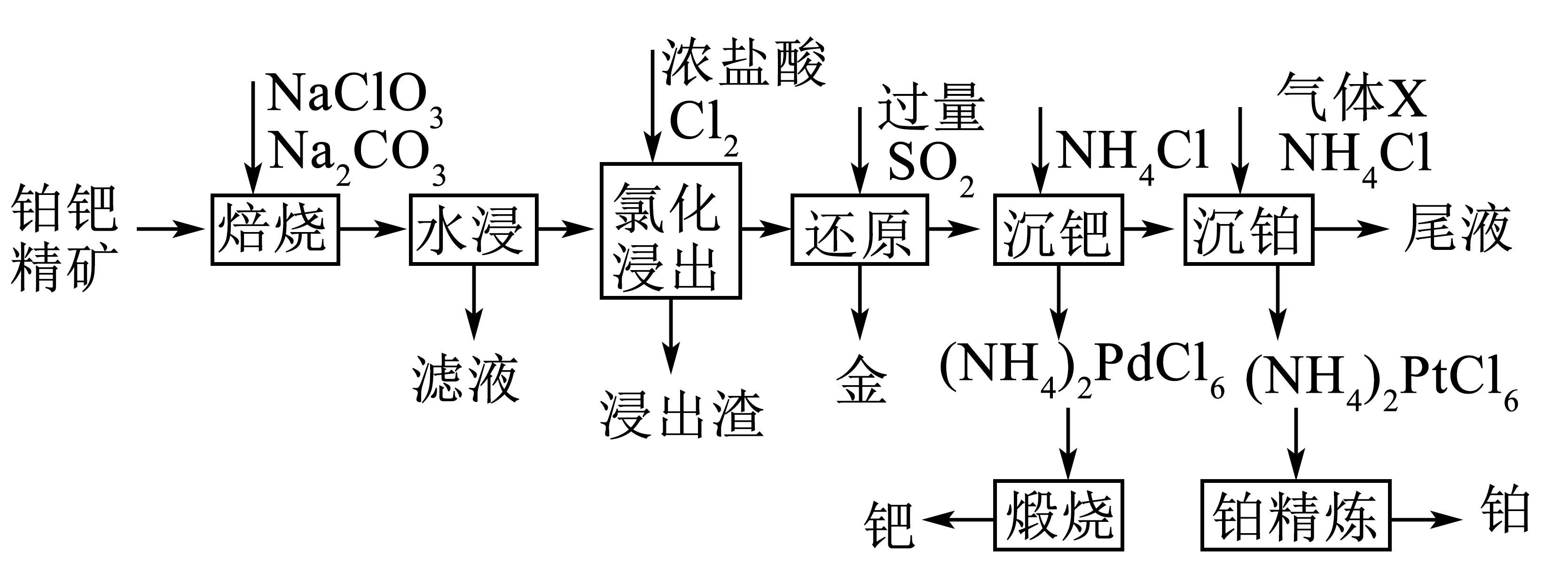
已知:①“氯化浸出”时,$\rm Au$、$\rm Pt$、$\rm Pd$以$\rm AuCl_{\text{4}}^{-}$、$\rm PtCl_{6}^{2-}$、$\rm PdCl_{6}^{2-}$形式存在;
②$\rm (NH_{4})_{2}PtCl_{6}$和$\rm (NH_{4})_{2}PdCl_{6}$难溶于水,$\rm (NH_{4})_{2}PtCl_{4}$易溶于水;
③室温:$\rm \textit{K}_{sp}[(NH_{4})_{2}PtCl_{6}]=5.7\times10^{-6}$;$\rm 57^{1/2}≈7.5$。
“焙烧”时,$\rm Se$、$\rm Te$转化为可溶于水的$\rm Na_{2}SeO_{3}$和$\rm Na_{2}TeO_{4.}$转化等物质的量的$\rm Se$、$\rm Te$时,消耗$\rm NaClO_{3}$的物质的量之比为 ;根据下图判断“焙烧”适宜的温度范围是 $\rm ($填标号$\rm )$。
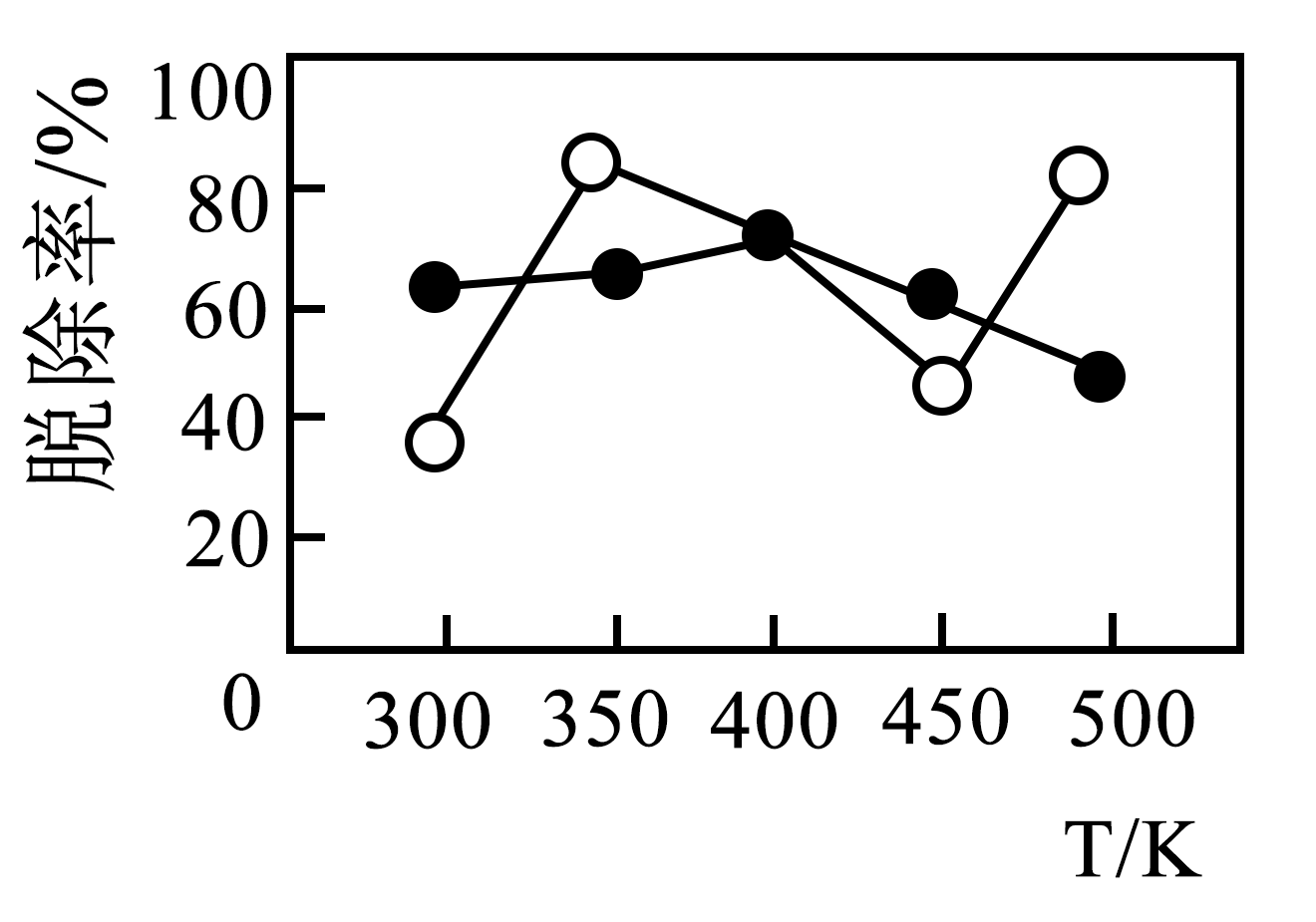
$\rm A$.$\rm 300-350\ K$ $\rm B$.$\rm 350-400\ K$ $\rm C$.$\rm 400-450\ K$ $\rm D$.$\rm 450-500\ K$
$\\rm 2:3$ ;$\\rm B$
"]]由得失电子数目守恒可知,硒、碲转化为$\rm Na_{2}SeO_{3}$和$\rm Na_{2}TeO_{4}$时,硒、碲化合价分别升高到$\rm +4$价和$\rm +6$价,则消耗氧化剂氯酸钠的物质的量比为$\rm 4:6=2:3$;由图可知,温度为$\rm 350—400\ K$时,硒、碲脱除率最高,所以“焙烧”适宜的条件为温度为$\rm 350—400\ K$;
一般条件下$\rm Au$很难被$\rm Cl_{2}$氧化,但用浓盐酸作浸出液,可使$\rm Au$被$\rm Cl_{2}$氧化,由此分析“氯化浸出”过程中浓盐酸的作用为 。
$\\rm Cl^{-}$做配体,与金离子形成稳定的配合物,提高$\\rm Au$的还原性,将$\\rm Au$转化为$\\text{AuCl}_{4}^{-}$,从而浸出$\\rm Au$
"]]一般条件下$\rm Au$很难被$\rm Cl_{2}$氧化,用浓盐酸作浸出液,盐酸电离出的$\rm Cl^{-}$做配体,与金离子形成稳定的配合物,提高$\rm Au$的还原性,将$\rm Au$转化为$\text{AuCl}_{4}^{-}$,从而浸出$\rm Au$;
“还原”得到金的离子方程式为 ;加入过量$\rm SO_{2}$的目的是 。
$\\rm 2\\text{AuCl}_{4}^{-}\\rm +3SO_{2}+6H_{2}O=2Au+8Cl^{-}+3\\text{SO}_{4}^{2-}\\rm +12H^{+}$ ;将$\\text{AuCl}_{4}^{-}$全部转化为$\\rm Au$,将$\\text{PtCl}_{6}^{2-}$还原为$\\text{PtCl}_{4}^{2-}$
"]]由分析可知,通入过量二氧化硫的目的是将溶液中的四氯合金酸根离子转化为金、六氯合铂酸根离子转化为四氯合铂酸根离子,得到金的反应的离子方程式为$\rm 2\text{AuCl}_{4}^{-}\rm +3SO_{2}+6H_{2}O=2Au+8Cl^{-}+3\text{SO}_{4}^{2-}\rm +12H^{+}$;
“煅烧”时还生成$\rm N_{2}$、$\rm NH_{4}Cl$和一种气体,该气体用少量水吸收后可重复用于“ ”操作单元。
氯化浸出
"]]由图可知,六氯合钯酸铵煅烧分解得到钯、氮气、氯化铵和氯化氢,反应生成的氯化氢可以重复用于氯化浸出操作单元;
“沉铂”先通入的气体$\rm X$为 $\rm ($填化学式$\rm )$。“沉铂”中,若向$\rm \textit{c}(PtCl_{6}^{2-}\rm )=0.125\;\rm mol/L$的溶液里加入等体积的$\rm NH_{4}Cl$溶液,使$\rm PtCl_{6}^{2-}$沉淀完全,则$\rm NH_{4}Cl$溶液浓度最小值为 $\rm \;\rm mol/L($结果保留两位小数,忽略溶液混合后体积的变化$\rm )$。
$\\rm Cl_{2}$; $\\rm 1.75$
"]]由分析可知,沉铂时先通入气体氯气,目的是将溶液中的四氯合铂酸根离子转化为六氯合铂酸根离子
$\rm (NH_{4})_{2}PdCl_6{\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\rm }2\text{NH}_{4}^{+}\rm +\text{PtCl}_{6}^{2-}$,$\rm \textit{K}_{sp}[(NH_{4})_{2}PtCl_{6}]=5.7\times10^{-6}$,$\text{PtCl}_{6}^{2-}$沉淀完全时浓度小于$\rm 1\times 10^{-5}\;\rm mol/L$,代入数据可得$\rm \textit{c}(\text{NH}_{4}^{+}\rm )=\sqrt{\dfrac{{{\textit{K}}_{\text{sp}}}}{\textit{c}\left( \text{PtCl}_{6}^{2-} \right)}}=\sqrt{\dfrac{5.7\times {{10}^{-6}}}{1\times {{10}^{-5}}}}\ \text{mol}/\text{L}=0.75\;\rm \text{mol}/\text{L}$,设原溶液体积为$V\rm \ L$,则沉淀需要溶液的物质的量为$2V\times0.125\rm \text{ mol}/\text{L}$,溶液等体积混合后,$\rm \textit{c}(\text{NH}_{4}^{+}\rm )=\dfrac{\textit{c}\left( \text{N}{{\text{H}}_{4}}\text{Cl} \right)\textit{V}}{2\textit{V}}$,则加入溶液的浓度最小为$\dfrac{0.125\times 2\;\rm \text{mol}/\text{L}+0.75\;\rm \text{mol}/\text{L}\times 2\textit{V}}{\textit{V}}=1.75\;\rm \text{mol}/\text{L}$;
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
