高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
对溴乙酰苯胺$\rm ($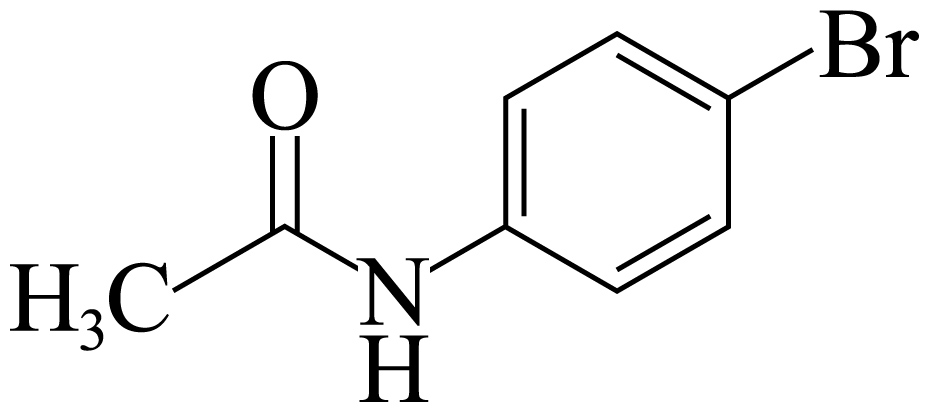 $\rm )$是医药合成的重要中间体,实验室常以乙酰苯胺$\rm ($
$\rm )$是医药合成的重要中间体,实验室常以乙酰苯胺$\rm ($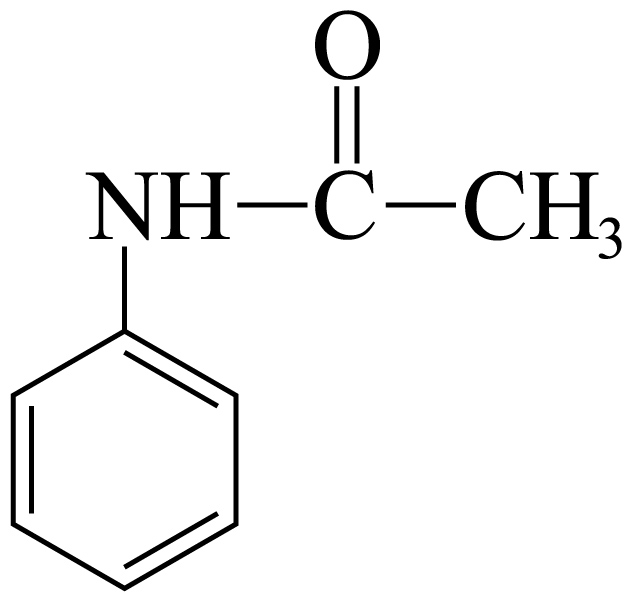 $\rm )$和$\rm \text{B}{{\text{r}}_{\text{2}}}$为原料来合成。实验步骤如下:
$\rm )$和$\rm \text{B}{{\text{r}}_{\text{2}}}$为原料来合成。实验步骤如下:
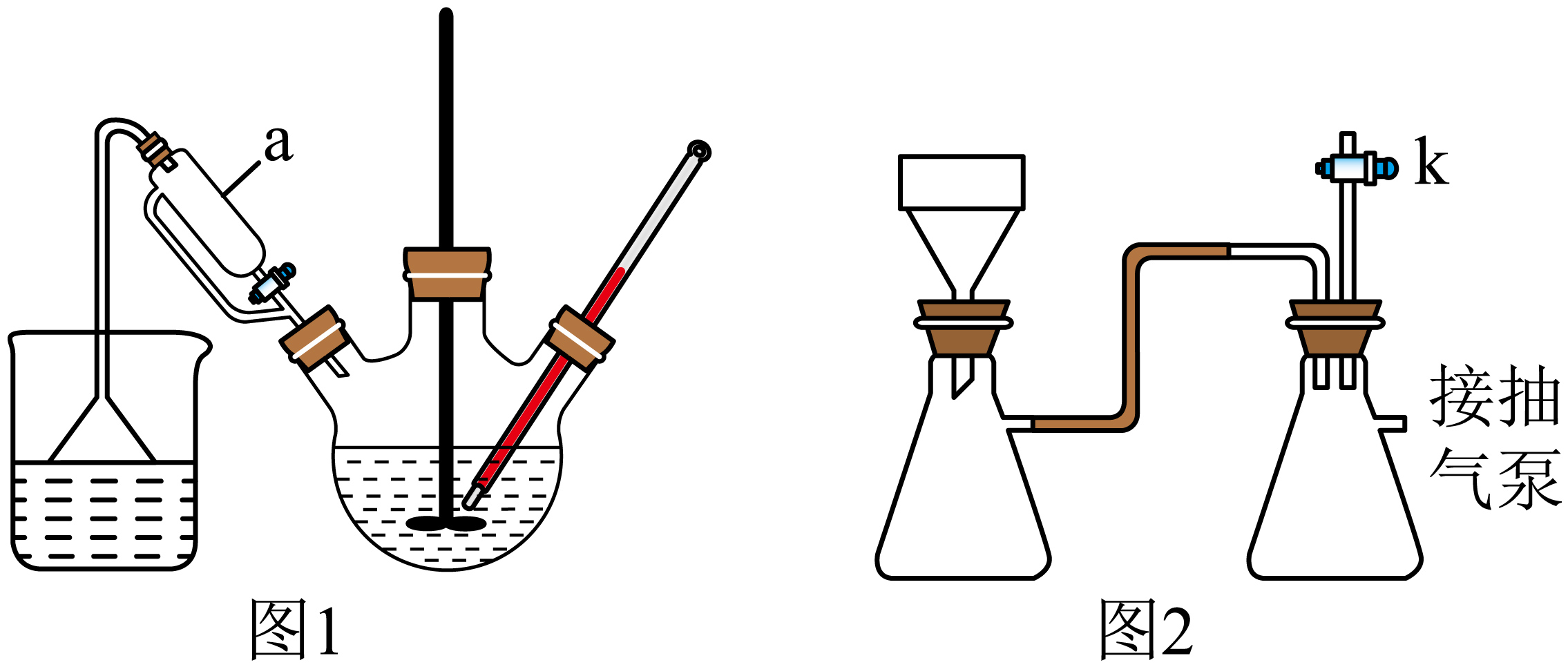
步骤Ⅰ.向一定体积的三颈烧瓶中,先加入$\rm 45.0\;\rm mL$乙醇,再加入$\rm 10.8\;\rm g$乙酰苯胺,充分溶解。将$\rm 13.0\;\rm g$溴溶解于$\rm 20.0\;\rm mL$冰醋酸中,装入图$\rm 1$所示装置的仪器$\rm a$中;
步骤Ⅱ.一边搅拌一边慢慢地滴加溴的冰醋酸溶液,滴加完毕后,在$\rm 45\;\rm ^\circ\rm C$下,继续搅拌反应$\rm 1$小时,然后将温度提高至$\rm 60\;\rm ^\circ\rm C$,再搅拌一段时间;
步骤Ⅲ.在搅拌下将反应后溶液慢慢加至含少量$\rm NaOH$的$\rm 100\;\rm mL$冰水中$\rm ($混合后溶液呈弱酸性$\rm )$,此时立即有固体析出,略有黄色,加入饱和的亚硫酸氢钠水溶液充分搅拌至黄色恰好褪去,将上述溶液放入冰水浴中慢慢冷却;
步骤Ⅳ.采用如图$\rm 2$所示装置过滤,并用冷水充分洗涤,干燥,经系列操作后得到$\rm 12.84\;\rm g$白色针状晶体,色谱检测其纯度为$\rm 80.0\%$。
已知:有关物质的部分性质见下表:
| 物质 | 相对分子质量 | 熔点$\rm /^\circ\rm C$ | 沸点$\rm /^\circ\rm C$ | 溶解性 |
| 乙酰苯胺 | $\rm 135$ | $\rm 113$ | $\rm 304$ | 白色结晶性粉末,微溶于冷水,溶于热水、乙醇等 |
| 对溴乙酰苯胺 | $\rm 214$ | $\rm 167$ | $\rm 353$ | 白色针状晶体,溶于苯、乙醇,微溶于热水,不溶于冷水 |
回答下列问题:
图$\rm 1$装置中,仪器$\rm a$的名称为 ,“步骤Ⅰ”中选用三颈烧瓶的规格是 $\rm ($填标号$\rm )$。
①$\rm 100\;\rm mL$ ②$\rm 150\;\rm mL$ ③$\rm 250\;\rm mL$ ④$\rm 50\;\rm mL$
恒压滴液漏斗; ②
"]]图$\rm 1$装置中,仪器$\rm a$的名称为恒压滴液漏斗;三颈烧瓶中加入$\rm 45.0\;\rm mL$乙醇,加入$\rm 10.8\;\rm g$乙酰苯胺,滴加$\rm 20.0\;\rm mL$溴的冰醋酸溶液,三颈烧瓶中液体体积大于三分之一而小于三分之二,则“步骤Ⅰ”中选用三颈烧瓶的规格是②$\rm 150\;\rm mL$合适;
乙醇和冰醋酸的作用是 。
充当溶剂,乙醇和冰醋酸互溶,使溴分子和乙酰苯胺充分接触,充分反应
"]]已知,乙酰苯胺微溶于冷水,溶于热水、乙醇等,实验中乙醇和冰醋酸的作用是充当溶剂,乙醇和冰醋酸互溶,使溴分子和乙酰苯胺充分接触,充分反应;
“步骤Ⅲ”两次慢慢冷却的目的是 ,加入饱和的亚硫酸氢钠水溶液黄色恰好褪去时的离子方程式为 。
吸收酸和碱中和放出的热量,并降低对溴乙酰苯胺溶解度,同时得到大颗粒对溴乙酰苯胺晶体; $\\text{HSO}_{\\text{3}}^{-}+{{\\text{H}}_{\\text{2}}}\\text{O}+\\text{B}{{\\text{r}}_{\\text{2}}}=2\\text{B}{{\\text{r}}^{-}}+\\text{SO}_{4}^{2-}+\\text{3}{{\\text{H}}^{+}}\\rm ($或$\\text{HSO}_{\\text{3}}^{-}+{{\\text{H}}_{\\text{2}}}\\text{O}+\\text{B}{{\\text{r}}_{\\text{2}}}+\\text{3C}{{\\text{H}}_{\\text{3}}}\\text{CO}{{\\text{O}}^{-}}=\\text{2B}{{\\text{r}}^{-}}+\\text{SO}_{4}^{2-}+3\\text{C}{{\\text{H}}_{\\text{3}}}\\text{COOH}\\rm )$
"]]已知,对溴乙酰苯胺不溶于冷水;反应后溶液加入含少量$\rm NaOH$的$\rm 100\;\rm mL$冰水中,氢氧化钠和酸发生中和反应放热,会导致温度升高,“步骤Ⅲ”两次慢慢冷却的目的是吸收酸和碱中和放出的热量,并降低对溴乙酰苯胺溶解度,同时得到大颗粒对溴乙酰苯胺晶体;显黄色,说明含有过量溴单质,溴单质具有氧化性,加入饱和的亚硫酸氢钠水溶液黄色恰好褪去,则溴单质氧化亚硫酸氢根离子为硫酸根离子同时生成溴离子,离子方程式为$\text{HSO}_{\text{3}}^{-}+{{\text{H}}_{\text{2}}}\text{O}+\text{B}{{\text{r}}_{\text{2}}}=2\text{B}{{\text{r}}^{-}}+\text{SO}_{4}^{2-}+\text{3}{{\text{H}}^{+}}\rm ($或
$\text{HSO}_{\text{3}}^{-}+{{\text{H}}_{\text{2}}}\text{O}+\text{B}{{\text{r}}_{\text{2}}}+\text{3C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}}=\text{2B}{{\text{r}}^{-}}+\text{SO}_{4}^{2-}+3\text{C}{{\text{H}}_{\text{3}}}\text{COOH}\rm )$;
“步骤Ⅳ”中,图$\rm 2$装置停止实验时,先 $\rm ($填标号$\rm )$再 $\rm ($填标号$\rm )$,最后加入冰水充分洗涤。
$\rm a$.打开活塞$\rm K$ $\rm b$.关闭抽气泵
$\\rm a$; $\\rm b$
"]]“步骤Ⅳ”中,图$\rm 2$装置停止实验时,为防止倒吸,应先$\rm a$.打开活塞$\rm K$,使得装置与大气相通,再$\rm b$.关闭抽气泵,最后加入冰水充分洗涤。
本实验中,对溴乙酰苯胺产率为 ,若“步骤Ⅱ”加热时温度过高至$\rm 85\;\rm ^\circ\rm C$,将导致所测产率 $\rm ($填“偏大”“偏小”或“不变”$\rm )$。
$\\rm 60\\%$; 偏小
"]]$\rm 10.8\;\rm g$乙酰苯胺为$\dfrac{10.8\ \text{g}}{\text{135\;\rm g}/\text{mol}}\rm =0.8\;\rm mol$,理论上对溴乙酰苯胺的物质的量为$\dfrac{10.8\ \text{g}}{\text{135\;\rm g}/\text{mol}}\rm =0.8\;\rm mol$,经系列操作后得到$\rm 12.84\;\rm g$白色针状晶体,色谱检测对溴乙酰苯纯度为$\rm 80.0\%$,则本实验中,对溴乙酰苯胺产率为$\dfrac{12.84\ \text{g}\times 80\%}{0.8\;\rm \text{mol}\times 214\ \text{g}/\text{mol}}\times 100\%=60\text{ }\!\!\%\!\!\text{ }$,若“步骤Ⅱ”加热时温度过高至$\rm 85\;\rm ^\circ\rm C$,使得溴、乙酸、乙醇挥发,导致原料损耗,将导致实际所得产物质量减小、所测产率偏小。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
