高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
硒$\rm (Se)$广泛应用于农业和生物医药等领域,一种利用$\rm H_2Se$热解制备高纯硒的流程如下:
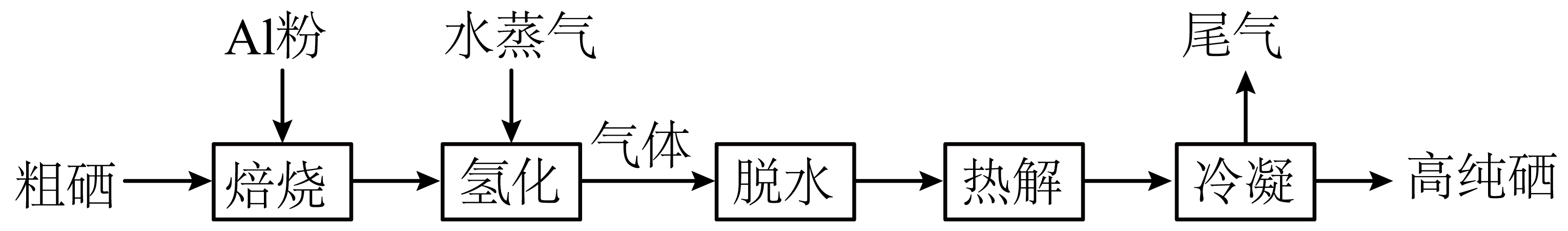
已知$\rm H_{2}Se$的沸点为$\rm 231\;K$,回答下列问题:
真空焙烧时生成的主要产物为$\text{A}{{\text{l}}_{2}}\text{S}{{\text{e}}_{3}}$,其中$\rm Se$的化合价为 ,$\rm Al$元素基态原子的电子排布式为 。
$-2$;$\\rm 1 s^2 2 s^2 2 p^6 3 s^2 3 p^1$
"]]$\rm Al$是$\rm IIIA$族元素,化合价为$\rm +3$价,则$\rm Se$化合价为$\rm -2$价;铝的基态电子排布式为$1{{\text{s}}^{2}}2{{\text{s}}^{2}}2{{\text{p}}^{6}}3{{\text{s}}^{2}}3{{\text{p}}^{1}}$;
氢化过程没有发生化合价的变化,$\rm Al$元素转化为${\rm Al_{2}O_{3}}·x\rm H_{2}O$,则反应的化学方程式为 。
$\\text{A}{{\\text{l}}_{\\text{2}}}\\text{S}{{\\text{e}}_{\\text{3}}}+\\left( {x+3} \\right){{\\text{H}}_{\\text{2}}}\\text{O=A}{{\\text{l}}_{\\text{2}}}{{\\text{O}}_{\\text{3}}}\\cdot {x}{{\\text{H}}_{\\text{2}}}\\text{O+3}{{\\text{H}}_{\\text{2}}}\\text{Se}$
"]]“氢化”过程是$\text{A}{{\text{l}}_{2}}\text{S}{{\text{e}}_{3}}$与水蒸气反应生成${{\text{H}}_{2}}\text{Se}\left( \text{g} \right)$,化学方程式为$\text{A}{{\text{l}}_{\text{2}}}\text{S}{{\text{e}}_{\text{3}}}+\left( {x+3} \right){{\text{H}}_{\text{2}}}\text{O=A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}\cdot {x}{{\text{H}}_{\text{2}}}\text{O+3}{{\text{H}}_{\text{2}}}\text{Se}$;
热解反应:${{\text{H}}_{2}}\text{Se}\left( \text{g} \right)\rightleftharpoons \text{Se}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta { H}\gt 0$。冷凝时,将混合气体温度迅速降至$\rm 500\;K$得到固态硒。$\rm Se$由气态直接转变为固态的过程称为 。迅速降温的目的 ;冷凝后尾气的成分为 $\rm ($填化学式$\rm )$。
凝华;减少$\\mathrm{H}_2 \\mathrm{Se}$生成,提高$\\rm Se$产率;${{\\text{H}}_{2}}$,$\\mathrm{H}_2 \\mathrm{Se}$
"]]从气态变为固态的过程为凝华;已知热解正向是吸热反应,降温时,为避免平衡逆向移动,需要迅速冷凝$\rm Se$蒸汽,故目的是减少$\mathrm{H}_2 \mathrm{Se}$生成,提高$\rm Se$产率;尾气种含有${{\text{H}}_{2}}$以及少量的$\mathrm{H}_2 \mathrm{Se}$;
$\rm Se$的含量可根据行业标准$\rm YS/T\; 226.12-2009$进行测定,测定过程中$\rm Se$的化合价变化如下:
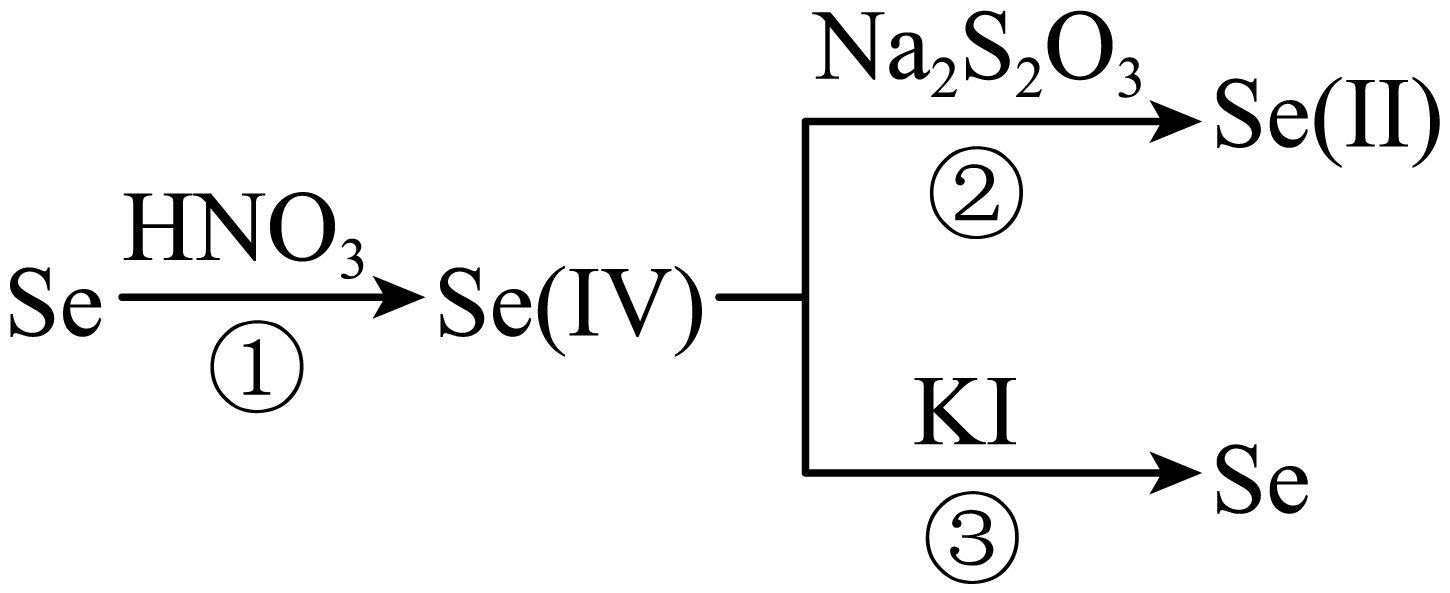
称取粗硒样品$\rm 0.1000\;\rm g$,经过程①将其溶解转化为弱酸$\rm H_{2}SeO_{3}$,并消除测定过程中的干扰。在酸性介质中,先加入$\rm 0.1000\;\rm mol·L^{-1}\; Na_{2}S_{2}O_{3}$标准溶液$\rm 40.00\;\rm mL$,在加入少量$\rm KI$和淀粉溶液,继续用$\rm Na_{2}S_{2}O_{3}$标准溶液滴定至蓝色消失为终点$\rm ($原理为${{\text{I}}_{2}}+2\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}=2\text{NaI}+\text{N}{{\text{a}}_{2}}{{\text{S}}_{4}}{{\text{O}}_{6}}\rm )$,又消耗$\rm 8.00\;\rm mL$。过程②中$\rm Se(IV)$与$\rm Na_{2}S2O_{3}$反应的物质的量之比为$\rm 1: 4$,且反应最快。过程③的离子方程式为 。该样品中$\rm Se$的质量分数为 。
$4{{\\text{H}}^{+}}+{{\\text{H}}_{2}}\\text{Se}{{\\text{O}}_{3}}+4{{\\text{I}}^{-}}=2{{\\text{I}}_{2}}+\\text{Se}+3{{\\text{H}}_{2}}\\text{O}$;$\\rm 94.8\\%$
"]]反应③是$\text{Se}\left( \text{IV} \right)$被$\rm KI$还原为$\rm Se$的过程,离子方程式为:$4{{\text{H}}^{+}}+{{\text{H}}_{2}}\text{Se}{{\text{O}}_{3}}+4{{\text{I}}^{-}}=2{{\text{I}}_{2}}+\text{Se}+3{{\text{H}}_{2}}\text{O}$;
第一次加入$\rm 40.00\;\rm mL$的$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$溶液和$\rm KI$溶液,二者同时做还原剂,将${{\text{H}}_{2}}\text{Se}{{\text{O}}_{3}}$还原为$\rm Se$,第二次再加入同浓度的$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$滴定上一步生成的碘单质,整个过程相当于$\rm 48\;\rm mL\; 0.1\;\rm mol/L$的$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$溶液与${{\text{H}}_{2}}\text{Se}{{\text{O}}_{3}}$反应,根据已知条件$\rm Se(IV)$与$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$反应的物质的量之比为$1:4$,则${n}\left[\rm {Se}\left( \rm IV\right) \right]=\dfrac{{1}}{{4}}\times{ 48 }\times{ 1}{{{0}}^{{-3}}}\times{ 0}{.1=1}{.2 }\times{ 1}{{{0}}^{{-3}}}\;\rm {mol}$,样品中$\rm Se$的含量:$\dfrac{{1}{.2 }\times{ 1}{{{0}}^{{-3}}}\;\rm{mol }\times{ 79\;\rm g/mol}}{{0}{.1\;\rm g}}\times{ 100 }\%{ =94}{.8 }\%$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
