高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
铋酸钠$\rm ((NaBi{{O}_{3}})$是一种新型的光催化剂。实验室利用如图所示装置制取铋酸钠。$\rm ($加热和夹持仪器已略去$\rm )$
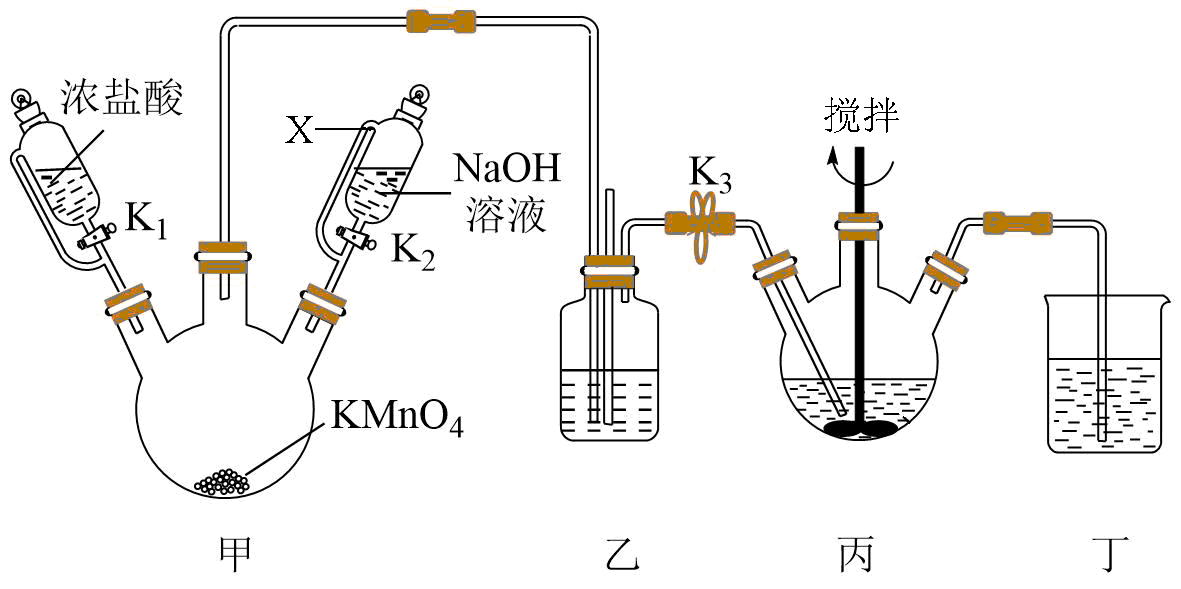
已知:①$\rm (Bi{{(OH)}_{3}}$是难溶于水的白色固体;
②$\rm NaBi{{O}_{3}}$为浅黄色固体。不溶于冷水,在空气、热水及酸溶液中发生分解;
③$\rm Bi^{3+}$在酸性水溶液中呈无色。
回答下列问题:
Ⅰ.制取铋酸钠
检查装置气密性并加入试剂,装置丙中盛放$\rm Bi{{(OH)}_{3}}$固体与过量$\rm NaOH$溶液的混合物,打开$\rm K_{1}$、$\rm K_{3}$,向三颈烧瓶中滴加浓盐酸。仪器$\rm X$的名称为 ;装置丙中发生反应的离子方程式为 。
恒压滴液漏斗 ;$\\rm Bi{{(OH)}_{3}}+3O{{H}^{-}}+N{{a}^{+}}+C{{l}_{2}}=NaBi{{O}_{3}}+2C{{l}^{-}}+3{{H}_{2}}O$
"]]仪器$\rm X$的名称:恒压滴液漏斗;丙装置中$\rm Bi{{(OH)}_{3}}$在$\rm NaOH$溶液环境下与氯气发生反应生成$\rm NaBiO_{3}$:$\rm Bi{{(OH)}_{3}}+3O{{H}^{-}}+N{{a}^{+}}+C{{l}_{2}}=NaBi{{O}_{3}}+2C{{l}^{-}}+3{{H}_{2}}O$;
装置乙中间长导管的作用是 。
平衡装置内外气压
"]]装置乙中间长导管与外界相连通,可起到平衡气压的作用;
当装置丙中反应已完成,立即关闭$\rm K_{1}$、$\rm K_{3}$,打开$\rm K_{2}$,向甲中加入足量$\rm NaOH$溶液,作用是 ;装置丁中盛放$\rm NaOH$溶液,其中发生反应的化学方程式为 。
可防止$\\rm NaBi{{O}_{3}}$分解,还能吸收多余氯气 ;$\\rm 2NaOH+C{{l}_{2}}=NaCl+NaClO+{{H}_{2}}O$
"]]$\rm NaBi{{O}_{3}}$在空气、热水及酸溶液中发生分解,所以反应完成后加入足量$\rm NaOH$溶液,可防止$\rm NaBi{{O}_{3}}$分解,还能吸收多余氯气;丁中的氢氧化钠溶液可吸收多余氯气:$\rm 2NaOH+C{{l}_{2}}=NaCl+NaClO+{{H}_{2}}O$;
Ⅱ.铋酸钠的分离提纯
反应结束后,为了从装置丙中获取$\rm NaBiO_{3}$粗产品,下列选项中最合理的操作组合是 $\rm ($填标号$\rm )$。
$\rm a$.在冰水中冷却
$\rm b$.用普通漏斗过滤
$\rm c$.用布氏漏斗抽滤
$\rm d$.冷水洗涤
$\rm e$.热水洗涤
$\rm f$.自然晾干
$\rm g$.在干燥器中干燥
$\\rm acdg$
"]]据已知信息,$\rm NaBi{{O}_{3}}$不溶于冷水,在空气或热水中逐渐分解,为从丙中获取粗产品:
$\rm a$.在冰水中冷却,合理;
$\rm b$.用普通漏斗过滤,延长了过量时间,增大铋酸钠分解可能,不合理;
$\rm c$.用布氏漏斗抽滤,加快过滤,合理;
$\rm d$.冷水洗涤,减少溶解损失,合理;
$\rm e$.热水洗涤,由于铋酸钠在热水中逐渐分解,不合理;
$\rm f$.自然晾干,暴露空气中太久,铋酸钠分解,不合理;
$\rm g$.在干燥器中干燥,减少与空气接触,合理;
故选$\rm acdg$;
Ⅲ.铋酸钠纯度的测定
取上述制得的$\rm NaBiO_{3}$粗产品$m\ \rm g$,加入足量的稀硫酸和$\rm MnS{{O}_{4}}$稀溶液使其完全反应,生成$\rm Bi^{3+}$,溶液变为紫红色。将反应后的溶液准确配制成$\rm 100\ mL$溶液,取$\rm 25.00\ mL$用$n\ \rm mol/L$的$\rm H_{2}C_{2}O_{4}$标准溶液滴定,到达滴定终点时消耗$\rm H_{2}C_{2}O_{4}$溶液$V\ \rm mL$。该产品的纯度是 $\rm ($用含$n$、$m$、$V$的代数式表示$\rm )$。
$\\dfrac{112nV}{m}$$\\%$
"]]$\rm NaBi{{O}_{3}}$将$\rm MnS{{O}_{4}}$氧化为$\rm MnO_{4}^{-}$,自身被还原为$\rm B{{i}^{3+}}$,$\rm MnO_{4}^{-}$被$\rm {{H}_{2}}{{C}_{2}}{{O}_{4}}$还原,根据得失电子守恒:$\rm 2M{{n}^{2+}}+5NaBi{{O}_{3}}+14{{H}^{+}}=2MnO_{4}^{-}+5N{{a}^{+}}+5B{{i}^{3+}}+7{{H}_{2}}O$,关系式:$\rm 5NaBi{{O}_{3}}\sim2M{{n}^{2+}}\sim2MnO_{4}^{-}\sim5{{H}_{2}}{{C}_{2}}{{O}_{4}}\sim10{{e}^{-}}$,则纯度:$\dfrac{n\ {\rm mol/L}\times V\times 1{{0}^{-3}}\ {\rm L} \times 4\times 280\rm \ g/mol}{m}\times 100\%=\dfrac{112nV}{m}\%$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
