高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
海水是巨大的宝库,从海水中提取溴的简单流程示意图如下。下列说法不正确的是$(\qquad)$
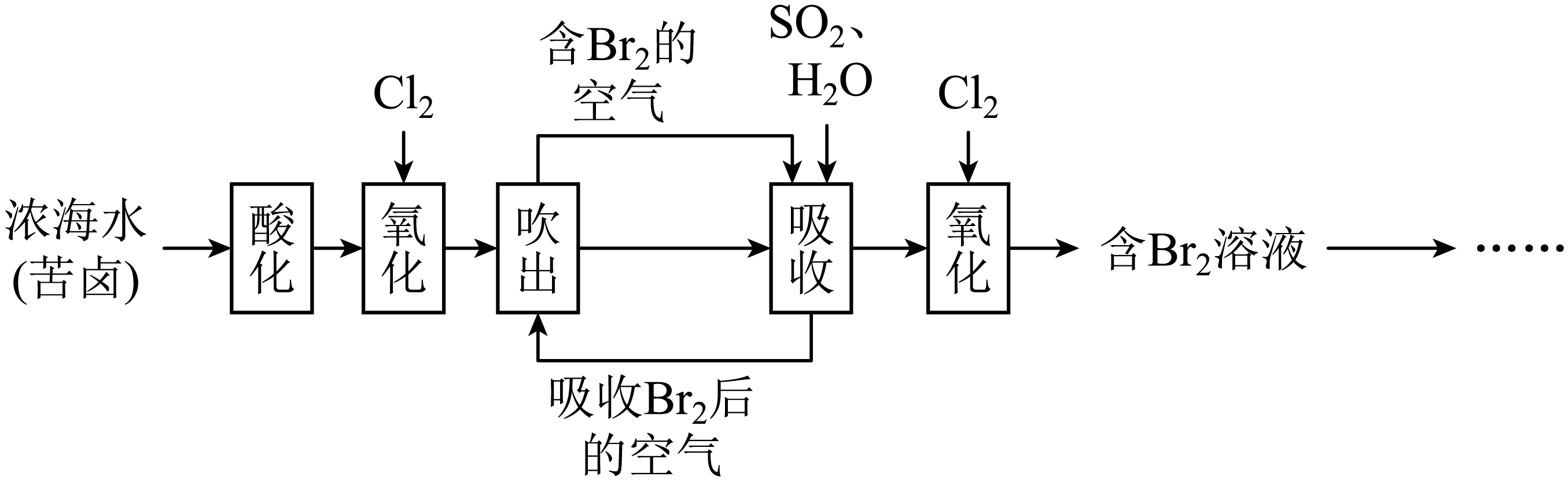
实验室通常采用“水封”的方法将液溴保存在无色试剂瓶中
","“吹出”时,常采用热空气吹出溴,说明溴的沸点较低
","流程中氧化$\\rm →$吸收$\\rm →$氧化的原因是海水中溴元素含量较低
","工业通常用$\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{O}}_{3}}$溶液代替二氧化硫吸收$\\text{B}{{\\text{r}}_{\\text{2}}}$,生成无色无味气体和$\\text{NaBr}{{\\text{O}}_{\\text{3}}}$,反应的化学方程式为:$3\\text{B}{{\\text{r}}_{2}}+3\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{O}}_{3}}=\\text{NaBr}{{\\text{O}}_{3}}+3\\text{C}{{\\text{O}}_{2}}\\uparrow +5\\text{NaBr}$
"]浓海水或苦卤酸化后,通入氯气,把溴离子氧化为溴单质,用空气从含$\rm Br_{2}$的海水将$\rm Br_{2}$吹出得到含$\rm Br_{2}$的空气,用二氧化硫吸收,得到吸收液,发生的反应为$\rm SO_{2}+2H_{2}O+Br_{2}=H_{2}SO_{4}+2HBr$,吸收溴单质后的空气可循环利用,再将氯气通入吸收液氧化溴离子,发生的反应为$\rm 2HBr+Cl_{2}=Br_{2}+2HCl$,得到溴单质的混合物,据此分析解答。
$\rm A$.溴密度比水大、易挥发且有毒,实验室通常采用“水封”的方法将液溴保存在棕色试剂瓶中,$\rm A$错误;
$\rm B$.“吹出”时,常采用热空气吹出溴,说明溴单质易挥发,溴的沸点较低,$\rm B$正确;
$\rm C$.海水中溴元素含量较低,流程中氧化$\rm →$吸收$\rm →$氧化的目的是富集溴单质,$\rm C$正确;
$\rm D$.工业通常用$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液代替二氧化硫吸收$\text{B}{{\text{r}}_{\text{2}}}$,生成无色无味气体二氧化碳和$\text{NaBr}{{\text{O}}_{\text{3}}}$,则溴发生自身氧化还原反应,同时生成溴化钠,反应的化学方程式为:$3\text{B}{{\text{r}}_{2}}+3\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}=\text{NaBr}{{\text{O}}_{3}}+3\text{C}{{\text{O}}_{2}}\uparrow +5\text{NaBr}$,$\rm D$正确。
故选:$\rm A$
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
