高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌$\rm ($含$\text{F}{{\text{e}}^{2+}}、\text{M}{{\text{n}}^{2+}}、\text{C}{{\text{u}}^{2+}}、\text{N}{{\text{i}}^{2+}}、\text{C}{{\text{d}}^{2+}}$等$\rm )$为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
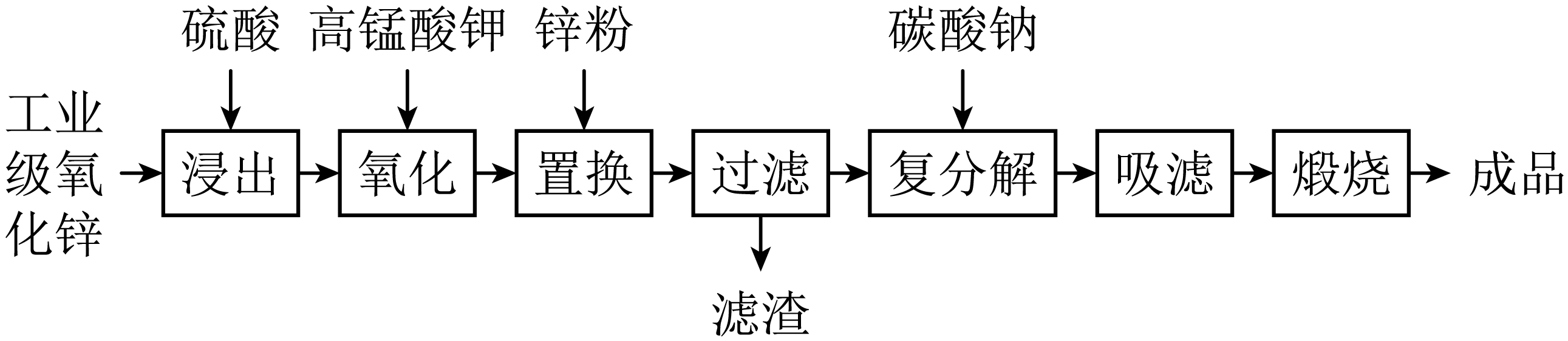
已知${{K}_{\text{sp}}}\left[ \text{Fe}{{(\text{OH})}_{3}} \right]=4.0\times {{10}^{-3\text{8}}}$。
回答下列问题:
浸出时,为了提高浸出效率可采取的措施有$\rm ($写两种$\rm )$: 。
搅拌、将氧化锌粉碎、升高温度、增加硫酸浓度等
"]]增大接触面积可以提高浸出效率,如搅拌、将氧化锌粉碎等;也可以适当升高温度、增加硫酸浓度等加快反应速率,提高浸出效率;
氧化时,加入$\text{KMn}{{\text{O}}_{\text{4}}}$溶液是为了将浸出液中的$\text{F}{{\text{e}}^{2+}}$和$\text{M}{{\text{n}}^{2+}}$均转化为沉淀而除去,$\rm ($溶液中$\text{Mn}$元素全部转化为$\text{Mn}{{\text{O}}_{\text{2}}}\rm )$,请分别写出$\text{KMn}{{\text{O}}_{\text{4}}}$除去$\text{F}{{\text{e}}^{2+}}$和$\text{M}{{\text{n}}^{2+}}$的离子方程式 , 。
$\\text{3F}{{\\text{e}}^{\\text{2+}}}\\text{+MnO}_{\\text{4}}^{-}\\text{+7}{{\\text{H}}_{\\text{2}}}\\text{O=3Fe}{{\\left( \\text{OH} \\right)}_{\\text{3}}}\\text{+Mn}{{\\text{O}}_{\\text{2}}}\\downarrow \\text{+5}{{\\text{H}}^{+}}$ ; $\\text{2MnO}_{\\text{4}}^{-}\\text{+3M}{{\\text{n}}^{\\text{2+}}}\\text{+2}{{\\text{H}}_{\\text{2}}}\\text{O=5Mn}{{\\text{O}}_{\\text{2}}}\\downarrow \\text{+4}{{\\text{H}}^{+}}$
"]]高锰酸钾氧化亚铁离子反应中,$\rm Mn$元素化合价由$\rm +7$价降低为$\rm MnO_{2}$中$\rm +4$价,共降低$\rm 3$价,$\rm Fe$元素化合价由$\rm +2$价升高为$\rm Fe(OH)_{3}$中$\rm +3$价,共升高$\rm 1$价,化合价升降最小公倍数为$\rm 3$,则高锰酸根离子的系数为$\rm 1$,$\rm Fe^{2+}$的系数为$\rm 3$,结合质量守恒配平反应为:$\text{3F}{{\text{e}}^{\text{2+}}}\text{+MnO}_{\text{4}}^{-}\text{+7}{{\text{H}}_{\text{2}}}\text{O=3Fe}{{\left( \text{OH} \right)}_{\text{3}}}\text{+Mn}{{\text{O}}_{\text{2}}}\downarrow \text{+5}{{\text{H}}^{+}}$;高锰酸钾氧化锰离子反应中高锰酸钾$\rm Mn$元素化合价由$\rm +7$价降低为$\rm MnO_{2}$中$\rm +4$价,共降低$\rm 3$价,锰离子中锰元素化合价由$\rm +2$价升高为二氧化锰中$\rm +4$价,共升高$\rm 2$价,化合价升降最小公倍数为$\rm 6$,则高锰酸根离子的系数为$\rm 2$,$\rm Mn^{2+}$的系数为$\rm 3$,结合质量守恒配平反应为:$\text{2MnO}_{\text{4}}^{-}\text{+3M}{{\text{n}}^{\text{2+}}}\text{+2}{{\text{H}}_{\text{2}}}\text{O=5Mn}{{\text{O}}_{\text{2}}}\downarrow \text{+4}{{\text{H}}^{+}}$;
加入锌粉的目的是 。
调节溶液$\\rm pH$,除去溶液中$\\rm Cu^{2+}$、$\\rm Ni^{2+}$、$\\rm Cd^{2+}$等
"]]加入锌粉的目的是和溶液中氢离子反应,调节溶液$\rm pH$,除去溶液中$\rm Cu^{2+}$、$\rm Ni^{2+}$、$\rm Cd^{2+}$等,使其转化为沉淀;
已知${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$浸出液中,$c\left( \text{F}{{\text{e}}^{2+}} \right)=5.04\text{ mg}\cdot {{\text{L}}^{-1}}$、$c\left( \text{M}{{\text{n}}^{2+}} \right)=1.65\text{ mg}\cdot {{\text{L}}^{-1}}$。
①若要除尽$1\text{ }{{\text{m}}^{3}}$上述浸出液中的$\text{F}{{\text{e}}^{2+}}$和$\text{M}{{\text{n}}^{2+}}$,需加入 $\text{g KMn}{{\text{O}}_{4}}$。
②加入$\text{KMn}{{\text{O}}_{\text{4}}}$溶液反应一段时间后,溶液中$c\left( \text{F}{{\text{e}}^{3+}} \right)=0.56\text{ mg}\cdot {{\text{L}}^{-1}}$,若溶液$\text{pH}=3$,则此时$\text{F}{{\text{e}}^{3+}}$ $\rm ($填“能”或“不能”$\rm )$生成沉淀。
$\\rm 7.9$ ; 不能
"]]①浸出液中$c\left( \text{F}{{\text{e}}^{\text{2+}}} \right)\text{=5}\text{.04 mg}\cdot {{\text{L}}^{\text{-1}}}\text{=5}\text{.04 g/}{{\text{m}}^{\text{3}}}$、$c\left( \text{M}{{\text{n}}^{\text{2+}}} \right)\text{=1}\text{.65 mg}\cdot {{\text{L}}^{\text{-1}}}\text{=1}\text{.65 g/}{{\text{m}}^{\text{3}}}$,$\rm 1$ $\rm m^{3}$上述浸出液中,$\rm Fe^{2+}$的物质的量为$\dfrac{\text{5}\text{.04 g/}{{\text{m}}^{\text{3}}}\times \text{1 }{{\text{m}}^{\text{3}}}}{\text{56 g/mol}}\text{=0}\text{.09 mol}$,$\rm Mn^{2+}$的物质的量$\dfrac{\text{1}\text{.65 g/}{{\text{m}}^{\text{3}}}\times \text{1 }{{\text{m}}^{\text{3}}}}{\text{55 g/mol}}\text{=0}\text{.03 mol}$,$\text{3F}{{\text{e}}^{\text{2+}}}\text{+MnO}_{\text{4}}^{-}\text{+7}{{\text{H}}_{\text{2}}}\text{O=3Fe}{{\left( \text{OH} \right)}_{\text{3}}}\text{+Mn}{{\text{O}}_{\text{2}}}\downarrow \text{+5}{{\text{H}}^{+}}$、$\text{2MnO}_{\text{4}}^{-}\text{+3M}{{\text{n}}^{\text{2+}}}\text{+2}{{\text{H}}_{\text{2}}}\text{O=5Mn}{{\text{O}}_{\text{2}}}\downarrow \text{+4}{{\text{H}}^{+}}$,可知需要高锰酸钾的物质的量为$\text{0}\text{.09 mol}\times \dfrac{\text{1}}{\text{3}}\text{+0}\text{.03 mol}\times \dfrac{\text{2}}{\text{3}}\text{=0}\text{.05 mol}$,需要高锰酸钾的质量为$\rm 0.05$ $\rm mol\times 158$ $\rm g/mol=7.9$ $\rm g$;
②溶液中$c\left( \text{F}{{\text{e}}^{\text{3+}}} \right)\text{=0}\text{.56 mg}\cdot {{\text{L}}^{\text{-1}}}\text{=1}{{\text{0}}^{\text{-5}}}\text{ mol/L}$,若溶液$\text{pH}=3$,$\rm pOH=11$,则$Q={{c}^{\text{3}}}\left( \text{O}{{\text{H}}^{-}} \right)c\left( \text{F}{{\text{e}}^{\text{3+}}} \right)\text{=1}{{\text{0}}^{\text{-5}}}\times \text{1}{{\text{0}}^{\text{-11}\times \text{3}}}={{10}^{\text{-38}}}\lt {{K}_{\text{sp}}}\left[ \text{Fe}{{(\text{OH})}_{3}} \right]=4.0\times {{10}^{-3\text{8}}}$,故此时$\text{F}{{\text{e}}^{3+}}$不能生成沉淀。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
