高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
以湿法炼锌过程中产出的钴锰渣$\rm ($主要成分为$\text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$、$\text{CoO}$、$\text{NiO}$、$\text{Mn}{{\text{O}}_{2}}$,含少量$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$、$\text{ZnO}$、$\text{CaO}$等$\rm )$为原料,分离回收钴、镍的工艺流程如图所示。
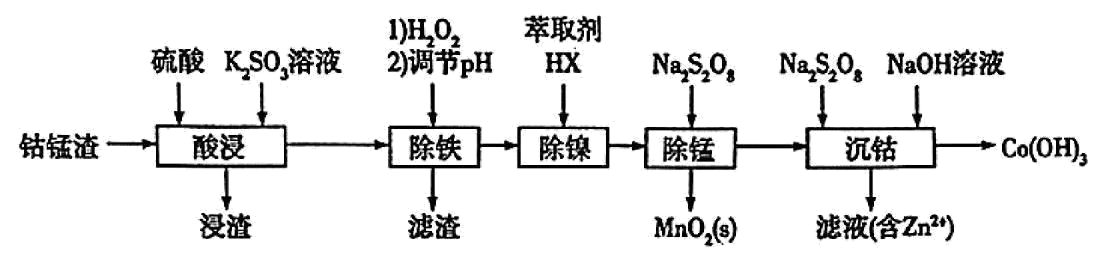
回答下列问题:
“酸浸”时,可能产生的一种有毒气体是 $\rm ($填化学式$\rm )$。
$\\text{S}{{\\text{O}}_{2}}$
"]]“酸浸”时,${{\text{K}}_{2}}\text{S}{{\text{O}}_{3}}$与${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$能发生复分解反应生成$\text{S}{{\text{O}}_{2}}$气体,故有毒气体为$\text{S}{{\text{O}}_{2}}$;
已知“滤渣”的主要成分是$\text{Fe}{{\left( \text{OH} \right)}_{3}}$。“除铁”过程中将$\text{pH}$控制在$\rm 3.7$∼$\rm 4.0$范围内的原因是 。
$\\text{pH}$偏低,$\\text{F}{{\\text{e}}^{3+}}$沉淀不完全;$\\text{pH}$偏高,$\\text{N}{{\\text{i}}^{2+}}$、$\\text{C}{{\\text{o}}^{2+}}$等离子会沉淀
"]]“除铁”过程中将$\text{pH}$控制在$\rm 3.7$∼$\rm 4.0$,若$\text{pH}$偏低,$\text{F}{{\text{e}}^{3+}}$沉淀不完全;$\text{pH}$偏高,$\text{N}{{\text{i}}^{2+}}$、$\text{C}{{\text{o}}^{2+}}$等离子会沉淀;
除镍:向滤液中加入某有机萃取剂$\text{HX}$,通过萃取、反萃取可以得到$\text{NiS}{{\text{O}}_{4}}$溶液。萃取原理可表示为$\text{N}{{\text{i}}^{2+}}\rm ($水层$\rm )+2\text{HX}\rm ($有机层$\rm )\rightleftharpoons \text{Ni}{{\left( \text{X} \right)}_{2}}\rm ($有机层$\rm )+2{{\text{H}}^{+}}\rm ($水层$\rm )$,在实验室模拟该操作,需要使用的主要玻璃仪器为 。
分液漏斗、烧杯
"]]实验操作为分液,故玻璃仪器为分液漏斗和烧杯;
过硫酸钠$\rm (\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}}\rm )$中阴离子的结构如图所示,其中硫元素的化合价为 。在酸性条件下,“除锰”时发生的主要反应的离子方程式为 。
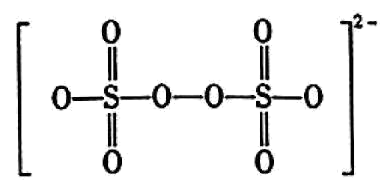
$+6$ ; $\\text{M}{{\\text{n}}^{2+}}+{{\\text{S}}_{2}}\\text{O}_{8}^{2-}+2{{\\text{H}}_{2}}\\text{O}=2\\text{SO}_{4}^{2-}+\\text{Mn}{{\\text{O}}_{2}}\\downarrow +4{{\\text{H}}^{+}}$
"]]${{\text{S}}_{2}}\text{O}_{8}^{2-}$中含过氧键,故$\text{S}$的化合价为$\rm +6$;“除锰”时$\text{M}{{\text{n}}^{2+}}$和${{\text{S}}_{2}}\text{O}_{8}^{2-}$反应生成$\text{SO}_{4}^{2-}$和$\text{Mn}{{\text{O}}_{2}}$沉淀,根据电子守恒、电荷守恒和质量守恒可配平方程式为$\text{M}{{\text{n}}^{2+}}+{{\text{S}}_{2}}\text{O}_{8}^{2-}+2{{\text{H}}_{2}}\text{O}=2\text{SO}_{4}^{2-}+\text{Mn}{{\text{O}}_{2}}\downarrow +4{{\text{H}}^{+}}$;
向“除锰”后的溶液中加入$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}}$溶液并控制溶液$\text{pH}$氧化沉$\text{C}{{\text{o}}^{2+}}$。由“除铁”和“沉钴”的工序可推断,还原性:$\text{C}{{\text{o}}^{2+}}$ $\text{F}{{\text{e}}^{2+}}\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
$\\rm \\lt $
"]]${{\text{H}}_{2}}{{\text{O}}_{2}}$可氧化$\text{F}{{\text{e}}^{2+}}$,却未氧化$\text{C}{{\text{o}}^{2+}}$,故还原性:$\text{C}{{\text{o}}^{2+}}\lt \text{F}{{\text{e}}^{2+}}$;
在隔绝空气氛围中灼烧$\text{Co}{{\left( \text{OH} \right)}_{3}}$,固体的失重率$\rm ($失重率$=\dfrac{初始质量-最终质量}{初始质量}\times 100\%\rm )$与温度的关系如图所示。若通过此法制备纯净的$\text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$,选择的最佳温度为 $\rm ($填“$\rm 290$ $\rm ^\circ\rm C$”“$\rm 500$ $\rm ^\circ\rm C$”或“$\rm 1000$ $\rm ^\circ\rm C$”$\rm )$。
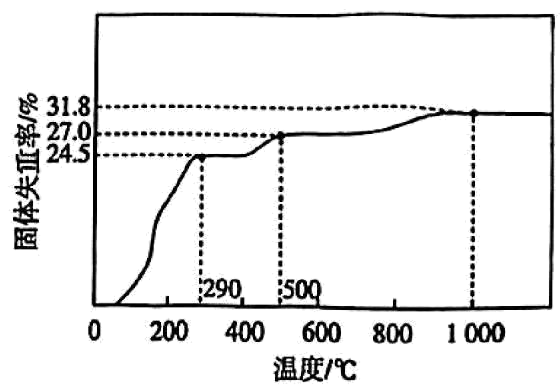
$\\rm 290$ $\\rm ^\\circ\\rm C$
"]]$\text{Co}{{\left( \text{OH} \right)}_{3}}$制备$\text{C}{{\text{o}}_{2}}{{\text{O}}_{3}}$的失重率$=1-\dfrac{59\times 2+16\times 3}{\left[ 2\times \left( 59+17\times 3 \right) \right]}\times 100\%=24.5\%$,故最佳温度为$\rm 290$ $\rm ^\circ\rm C$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
