高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,$\rm KI$、$\rm KIO_{3}$曾先后用于加碘盐中。$\rm KI$还可用于分析试剂、感光材料、制药等,其制备原理如下:
反应$\rm I$ : $\rm 3I_{2}+$ $\rm 6KOH=$ $\rm KIO_{3}$ $\rm +5KI+$ $\rm 3H_{2}O$
反应$\rm II$: $\rm 3H_{2}S+KIO_{3}=3S↓+KI+$ $\rm 3H_{2}O$
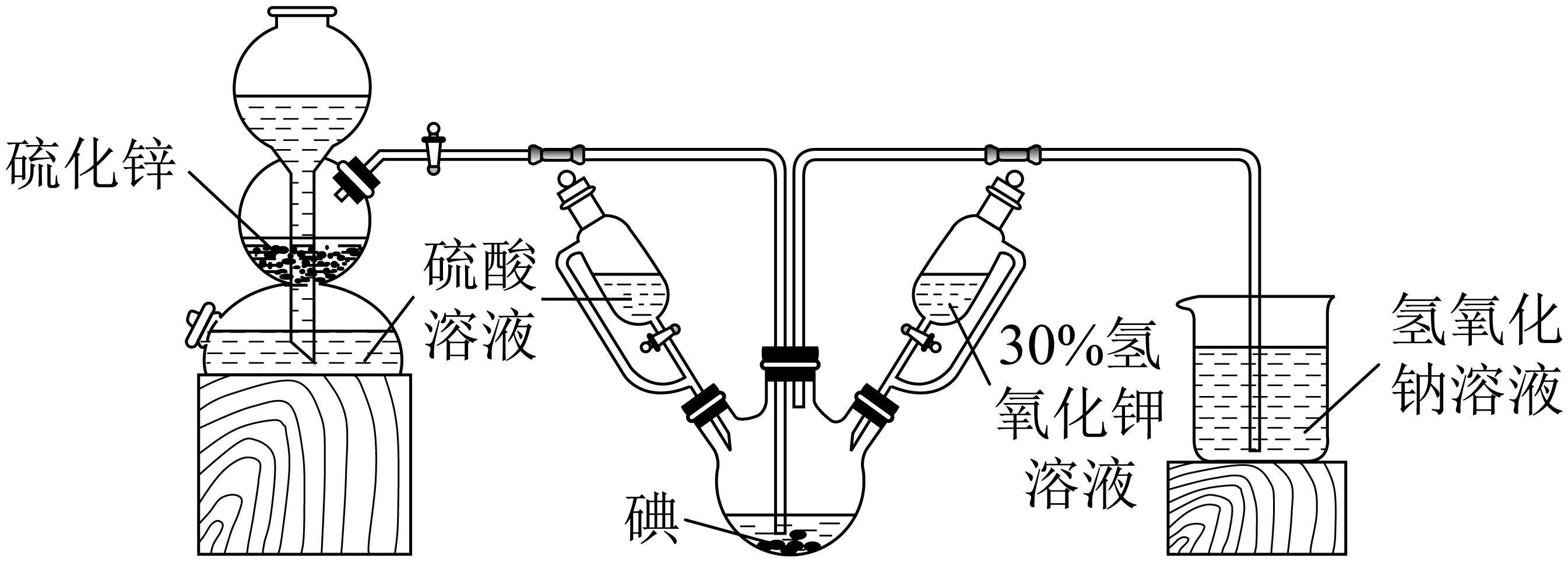
请回答有关问题。
启普发生器中发生反应的化学方程式是 ,装置中盛装$\rm 30\%$氢氧化钾溶液的仪器名称是 ;
$\\rm ZnS+H_{2}SO_{4}=H_{2}S↑+ZnSO_{4}$ ; 恒压滴液漏斗
"]]启普发生器中为硫化锌与硫酸的反应,制取硫化氢气体,其反应为$\text{ZnS+}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}={{\text{H}}_{\text{2}}}\text{S}\uparrow \text{+ZnS}{{\text{O}}_{\text{4}}}$,装置中盛装$\rm 30\%$氢氧化钾溶液的仪器名称是恒压滴液漏斗;
关闭启普发生器活塞,先滴入$\rm 30\%$的$\rm KOH$溶液。待观察到三颈烧瓶中溶液颜色由棕黄色变为无色 ,停止滴入$\rm KOH$溶液;然后 $\rm ($填操作$\rm )$,待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
打开启普发生器活塞,通入气体,使溶液酸化并加热
"]]根据题干,制取$\rm KI$时先制备$\rm KIO_{3}$,即先发生的是反应Ⅰ,然后才是反应Ⅱ,所以停止滴入$\rm KOH$溶液后的操作为打开启普发生器活塞,通入气体,使溶液酸化并加热;
把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有硫酸钡和 $\rm ($填名称$\rm )$。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
硫
"]]反应Ⅱ中还有硫单质生成,所以除了上述沉淀外,还有硫;
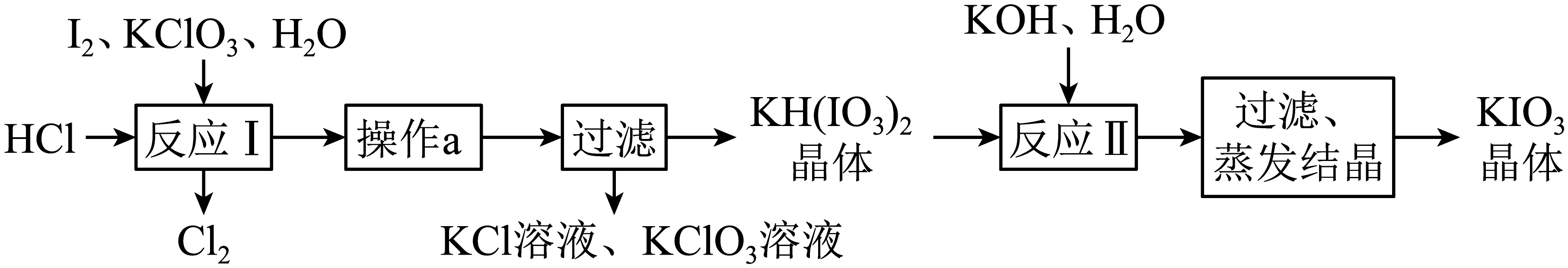
实验室模拟工业制备$\rm KIO_{3}$流程如下:
几种物质的溶解度见下表:
| $\rm KCl$ | $\rm KH(IO_{3})_{2}$ | $\rm KClO_{3}$ | |
| $\rm 25$ $\rm ^\circ\rm C$时的溶解度$\rm (g)$ | $\rm 20.8$ | $\rm 0.8$ | $\rm 7.5$ |
| $\rm 80$ $\rm ^\circ\rm C$时的溶解度$\rm (g)$ | $\rm 37.1$ | $\rm 12.4$ | $\rm 16.2$ |
①由上表数据分析可知,“操作$\text{a}$”是 ;
②用惰性电极电解$\rm KI$溶液也能制备$\rm KIO_{3}$,与电解法相比,上述流程制备$\rm KIO_{3}$的缺点是
蒸发浓缩、冷却结晶$\\rm ($或重结晶$\\rm )$ ; $\\rm KClO_{3}$和$\\rm I_{2}$反应时会产生有毒的氯气,污染环境
"]]根据表中数据,低温时有利于碘酸氢钾析出,所以操作为蒸发浓缩、冷却结晶$\rm ($或重结晶$\rm )$;电解制备碘酸钾时没有氯气等污染环境的气体产生,更环保,所以上述流程制备$\rm KIO_{3}$的缺点是$\rm KClO_{3}$和$\rm I_{2}$反应时会产生有毒的氯气,污染环境,故填$\rm KClO_{3}$和$\rm I_{2}$反应时会产生有毒的氯气,污染环境;
某同学为了测定上述流程生产的$\rm KIO_{3}$样品的纯度,进行了下列操作:
取$\rm 1.00$ $\rm g$样品溶于蒸馏水中并用硫酸酸化,再加入过量的$\rm KI$和少量的淀粉溶液,逐滴滴加$\rm 2.0$ $\rm mol·L^{-1}$ $\rm Na_{2}S_{2}O_{3}$溶液,恰好完全反应时共消耗$\rm 12.$ $\rm 60$ $\rm mL$ $\rm Na_{2}S_{2}O_{3}$溶液。该样品中$\rm KIO_{3}$的质量分数为 $\rm ($已知反应:$\rm I_{2}+2Na_{2}S_{2}O_{3}=2NaI+Na_{2}S_{4}O_{6})$。
$\\rm 89.88\\%$
"]]该测量方法为:将$\text{KI}{{\text{O}}_{\text{3}}}$转化为${{\text{I}}_{\text{2}}}$,然后再与$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$反应,根据消耗的$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$量来计算$\text{KI}{{\text{O}}_{\text{3}}}$的含量,根据反应${{\text{I}}_{\text{2}}}\text{+2N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}=\text{2NaI+N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{4}}}{{\text{O}}_{\text{6}}}$和$\text{KI}{{\text{O}}_{\text{3}}}\text{+5KI+3}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\text{=3}{{\text{I}}_{\text{2}}}\text{+3}{{\text{K}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\text{+3}{{\text{H}}_{\text{2}}}\text{O}$,可得$\text{KI}{{\text{O}}_{\text{3}}}\sim 3{{\text{I}}_{\text{2}}}\sim \text{6N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$,则反应消耗$\rm 12.$ $\rm 60$ $\rm mL$ $\rm Na_{2}S_{2}O_{3}$溶液,需要$\text{KI}{{\text{O}}_{\text{3}}}$的质量为$\dfrac{1}{6}\times 2.0\text{ mol/L}\times \text{12}\text{.60}\times {{10}^{-3}}\text{ L}\times 214\text{ g/mol=}\rm 0.8988$ $\rm g$,$\text{KI}{{\text{O}}_{\text{3}}}$分数为$\dfrac{\text{0}\text{.8988 g}}{\text{1 g}}\times 100\%=89.88\%$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
