高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
实验室以硫铁矿$\rm ($主要成分为$\text{Fe}{{\text{S}}_{2}}\rm )$为原料制备磷酸亚铁晶体$\rm [\text{F}{{\text{e}}_{3}}{{\left( \text{P}{{\text{O}}_{4}} \right)}_{2}}\cdot 8{{\text{H}}_{2}}\text{O}\rm ]$,其部分实验过程如图所示:
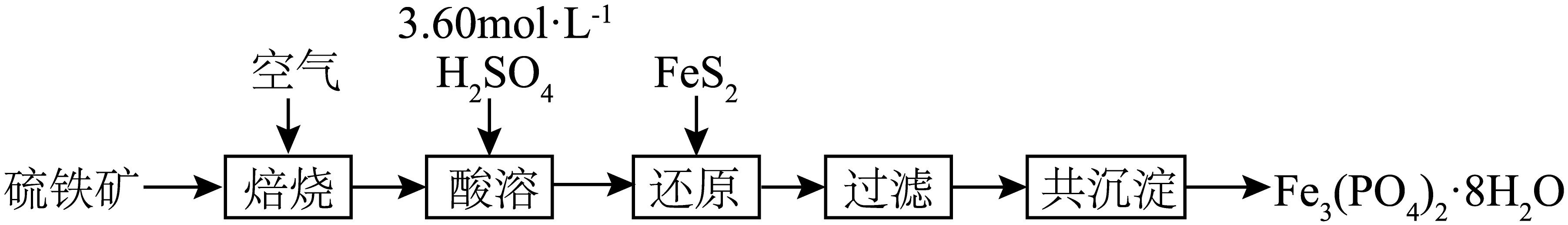
回答下列问题:
“焙烧”时,气体与矿料逆流而行,目的是 。
增大反应物接触面积,提高化学反应速率,使反应更充分
"]]“焙烧”时,气体与矿料逆流而行,目的是增大反应物接触面积,提高化学反应速率,使反应更充分;
用浓硫酸配制$250\ \text{mL }3.60\ \text{mol}\cdot {{\text{L}}^{-1}}$的硫酸,除量筒、烧杯、玻璃棒外,还必须使用的玻璃仪器有 。
胶头滴管、$250\\text{ mL}$容量瓶
"]]由浓硫酸配制$250\ \text{mL }3.60\ \text{mol}\cdot {{\text{L}}^{-1}}$的稀硫酸,故还必须使用的玻璃仪器有胶头滴管、$250\ \text{mL}$容量瓶;
“过滤”后滤渣的主要成分是$S$,则“还原”反应的离子方程式为 。
$\\text{Fe}{{\\text{S}}_{2}}+2\\text{F}{{\\text{e}}^{3+}}=2\\text{S}+3\\text{F}{{\\text{e}}^{2+}}$
"]]“过滤”后滤渣的主要成分是$\operatorname{S}$,“还原”反应是$\text{F}{{\text{e}}^{3+}}$和$\text{Fe}{{\text{S}}_{2}}$反应生成$S$和$\text{F}{{\text{e}}^{2+}}$,根据电子守恒、电荷守恒和质量守恒可配平方程式为$\text{Fe}{{\text{S}}_{2}}+2\text{F}{{\text{e}}^{3+}}=2\text{S}+3\text{F}{{\text{e}}^{2+}}$;
向“过滤”后的滤液中加入$\text{N}{{\text{a}}_{2}}\text{HP}{{\text{O}}_{4}}$,并用$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$或$\text{C}{{\text{H}}_{3}}\text{COONa}$调节溶液$\text{pH}$,“共沉淀”生成$\text{F}{{\text{e}}_{3}}{{\left( \text{P}{{\text{O}}_{4}} \right)}_{2}}\cdot 8{{\text{H}}_{2}}\text{O}$。
①用维生素$\rm C$稀溶液作底液,可提高产物的纯度,其原因是 。
②不使用$\text{NaOH}$调节溶液$\text{pH}$的原因是 。
③若使用$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$调节溶液$\text{pH}$,“共沉淀”反应的离子方程式为 。
维生素$\\rm C$具有还原性,可以防止$\\text{F}{{\\text{e}}^{2+}}$被氧化为$\\text{F}{{\\text{e}}^{3+}}$ ; $\\text{NaOH}$碱性强,容易造成局部$\\text{pH}$过高,生成$\\text{Fe}{{\\left( \\text{OH} \\right)}_{2}}$等杂质 ; $3\\text{F}{{\\text{e}}^{2+}}+2\\text{HPO}_{4}^{2-}+2\\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O}+6{{\\text{H}}_{2}}\\text{O}=\\text{F}{{\\text{e}}_{3}}{{\\left( \\text{P}{{\\text{O}}_{4}} \\right)}_{2}}\\cdot 8{{\\text{H}}_{2}}\\text{O}\\downarrow +2\\text{NH}_{4}^{+}$
"]]①用维生素$\rm C$稀溶液作底液,可提高产物的纯度,是因为维生素$\rm C$具有还原性,可以防止$\text{F}{{\text{e}}^{2+}}$被氧化为$\text{F}{{\text{e}}^{3+}}$,②不使用$\text{NaOH}$调节溶液$\text{pH}$是因为$\text{NaOH}$碱性强,容易造成局部$\text{pH}$过高,生成$\text{Fe}{{\left( \text{OH} \right)}_{2}}$等杂质,③$\text{F}{{\text{e}}^{2+}}$与$\text{HPO}_{4}^{2-}$反应生成$\text{F}{{\text{e}}_{3}}{{\left( \text{P}{{\text{O}}_{4}} \right)}_{2}}\cdot 8{{\text{H}}_{2}}\text{O}$,其中的${{\text{H}}^{+}}$与$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$中和,根据电荷守恒和质量守恒可配平方程式$3\text{F}{{\text{e}}^{2+}}+2\text{HPO}_{4}^{2-}+2\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}+6{{\text{H}}_{2}}\text{O}=\text{F}{{\text{e}}_{3}}{{\left( \text{P}{{\text{O}}_{4}} \right)}_{2}}\cdot 8{{\text{H}}_{2}}\text{O}\downarrow +2\text{NH}_{4}^{+}$;
测定$\text{F}{{\text{e}}_{3}}{{\left( \text{P}{{\text{O}}_{4}} \right)}_{2}}\cdot 8{{\text{H}}_{2}}\text{O}$产品中铁元素的质量分数$\rm ($假设杂质不参加反应$\rm )$:取$0.60\text{ g}$样品于锥形瓶中,加入稀硫酸溶解,水浴加热至$\rm 75$ $\rm ^\circ\rm C$,再加入$20.00\ \text{mL }0.0200\ \text{mol}\cdot {{\text{L}}^{-1}}\text{ KMn}{{\text{O}}_{4}}$溶液,充分反应后,使用$0.0200\text{ mol}\cdot {{\text{L}}^{-1}}$草酸$\left( {{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}} \right)$标准溶液滴定过量的$\text{KMn}{{\text{O}}_{4}}$至终点,消耗草酸溶液$20.00\ \text{mL}$。
已知:$5\text{F}{{\text{e}}^{2+}}+\text{MnO}_{4}^{-}+8{{\text{H}}^{+}}=\text{M}{{\text{n}}^{2+}}+5\text{F}{{\text{e}}^{3+}}+4{{\text{H}}_{2}}\text{O}$,$5{{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}+2\text{MnO}_{4}^{-}+6{{\text{H}}^{+}}=2\text{M}{{\text{n}}^{2+}}+10\text{C}{{\text{O}}_{2}}\uparrow +8{{\text{H}}_{2}}\text{O}$。
①若装草酸的滴定管用蒸馏水洗涤后未润洗,会导致测得的铁元素的含量 $\rm ($填“偏高”或“偏低”$\rm )$。
②该磷酸亚铁晶体样品中铁元素的质量分数为 。
偏低 ; $\\rm 11.2\\%$
"]]①装草酸的滴定管用蒸馏水洗涤后未润洗,导致草酸浓度降低,消耗的量变多,进而导致铁元素的含量偏低;②与草酸反应的$n\left( \text{KMn}{{\text{O}}_{4}} \right)=\dfrac{2}{5}n\left( {{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}} \right)=\dfrac{2}{5}\times 0.0200\,\text{ mol}\cdot {{\text{L}}^{-1}}\times 20.00\times {{10}^{-3}}\,\text{L}=1.6\times {{10}^{-4}}\,\text{mol}$,与$\text{F}{{\text{e}}^{2+}}$反应的$n\left( \text{KMn}{{\text{O}}_{4}} \right)=0.0200\text{ mol}\cdot {{\text{L}}^{-1}}\times 20.00\times {{10}^{-3}}\,\text{L}-1.6\times {{10}^{-4}}\,\text{mol}=2.4\times {{10}^{-4}}\,\text{mol}$,所以$n\left( \text{F}{{\text{e}}^{2+}} \right)=5n\left( \text{KMn}{{\text{O}}_{4}} \right)=5\times 2.4\times {{10}^{-4}}\,\text{mol}=1.2\times {{10}^{-3}}\,\text{mol}$,铁元素的质量分数$=1.2\times {{10}^{-3}}\ \text{mol}\times 56\text{ g}\cdot \text{mo}{{\text{l}}^{-1}}\div 0.6\text{ g}\times 100\%=11.2\%$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
