高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
以液晶显示屏生产过程中产生的废玻璃粉末$\rm ($含$\mathrm{CeO}_{2}$、$\text{Si}{{\text{O}}_{2}}$、$\text{F}{{\text{e}}_{2}}{{\text{O}}_{3}}$、$\text{A}{{\text{l}}_{2}}{{\text{O}}_{3}}$等$\rm )$为原料回收$\text{Ce}$的流程如图所示。
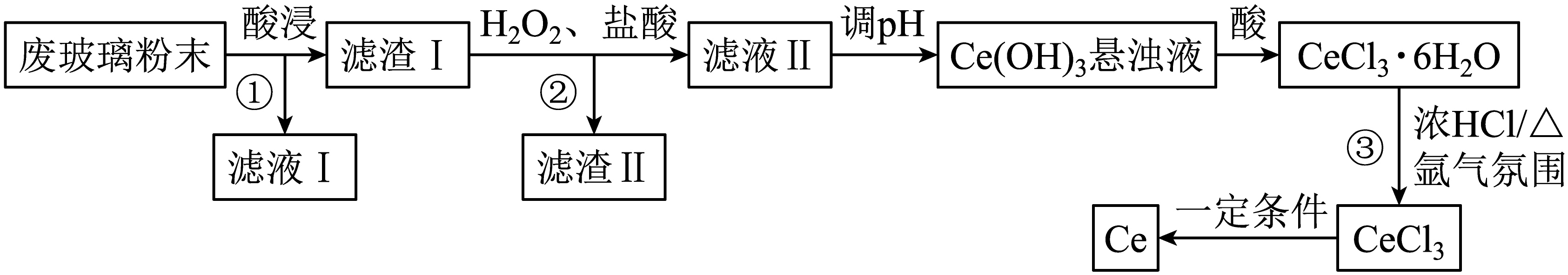
已知:
$ 1.$$\mathrm{CeO}_{2}$具有强氧化性,通常情况不与常见的无机酸反应。
$ 2.$几种阳离子转化为沉淀的$\rm pH$
| 金属阳离子 | $\text{F}{{\text{e}}^{3+}}$ | $\mathrm{Ce}^{3+}$ | $\text{A}{{\text{l}}^{3+}}$ | $\text{F}{{\text{e}}^{2+}}$ |
| 开始沉淀的$\rm pH$ | $\rm 1.5$ | $\rm 7.6$ | $\rm 3.4$ | $\rm 6.5$ |
| 沉淀完全的$\rm pH$ | $\rm 2.8$ | $\rm 9.4$ | $\rm 4.7$ | $\rm 9.0$ |
回答下列问题:
为了加快废玻璃粉末的酸浸速率,通常采用的方法有 $\rm ($至少写一种$\rm )$。
适当增大酸的浓度或适当升高温度或不断搅拌$\\rm ($答将样品粉碎不得分$\\rm )$
"]]根据影响反应速率的因素,为了加快废玻璃粉末的酸浸速率,通常采用的方法有适当增大酸的浓度或适当升高温度或不断搅拌;
操作①和②的名称为 。
过滤
"]]操作①和②都是固液分离的方法,均为过滤;
请写出加入${{\text{H}}_{2}}{{\text{O}}_{2}}$的与$\mathrm{CeO}_{2}$反应的离子方程式 。
$\\text{2Ce}{{\\text{O}}_{\\text{2}}}+{{\\text{H}}_{\\text{2}}}{{\\text{O}}_{2}}+6{{\\text{H}}^{+}}=2\\text{C}{{\\text{e}}^{3+}}+{{\\text{O}}_{\\text{2}}}\\uparrow +4{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]$\rm CeO_{2}$具有强氧化性,加入$\rm H_{2}O_{2}$作还原剂,酸性条件下$\rm CeO_{2}$被还原为$\rm Ce^{3+}$,过氧化氢中氧被氧化为氧气,反应为:$\text{2Ce}{{\text{O}}_{\text{2}}}+{{\text{H}}_{\text{2}}}{{\text{O}}_{2}}+6{{\text{H}}^{+}}=2\text{C}{{\text{e}}^{3+}}+{{\text{O}}_{\text{2}}}\uparrow +4{{\text{H}}_{\text{2}}}\text{O}$;
操作②中也需要调节$\rm pH$,调节$\rm pH$的范围为 ,常温下,向滤液Ⅱ中加入碱调节溶液的$\mathrm{pH}=9$时,$\text{Ce}{{\left( \text{OH} \right)}_{3}}$悬浊液中$ {c}\left( \text{C}{{\text{e}}^{3+}} \right)=$ $\mathrm{mol} \cdot \mathrm{L}^{-1}$[已知:$\rm 25\;\rm ^\circ\rm C$时,$\text{Ce}{{\left( \text{OH} \right)}_{3}}$的${{K}_{\text{sp}}}=8.0\times {{10}^{-21}}$]。
$\\rm 4.7\\leqslant pH\\lt 7.6$;$8.0\\times {{10}^{-6}}$
"]]操作②中也需要调节$\rm pH$,使得铁离子、铝离子成为沉淀,而$\mathrm{Ce}^{3+}$不沉淀,结合表数据,调节$\rm pH$的范围为$\rm 4.7\leqslant pH\lt 7.6$;常温下,向滤液Ⅱ中加入碱调节溶液的$\mathrm{pH}=9$时,$\rm pOH=5$,则$\text{Ce}{{\left( \text{OH} \right)}_{3}}$悬浊液中$ {c}\left( \text{C}{{\text{e}}^{\text{3+}}} \right)=\dfrac{{{ {K}}_{\text{sp}}}}{{{ {c}}^{\text{3}}}\left( \text{O}{{\text{H}}^{-}} \right)}=\dfrac{\text{8}\text{.0}\times \text{1}{{\text{0}}^{\text{-21}}}}{{{10}^{-5\times 3}}}\text{ mol/L}=\text{8}\text{.0}\times \text{1}{{\text{0}}^{\text{-6}}}\text{ mol/L}$;
操作③需加入浓$\text{HCl}$的原因是 ,在氩气氛围中加热的目的是 。
抑制$\\mathrm{Ce}^{3+}$的水解;防止加热过程中$\\text{CeC}{{\\text{l}}_{3}}$被氧化
"]]$\rm Ce^{3+}$水解方程式为$\text{C}{{\text{e}}^{\text{3+}}}\text{+3}{{\text{H}}_{\text{2}}}\text{O}\underset{{}}{\overset{{}}{\mathop{\rightleftharpoons }}}\,\text{Ce}{{\left( \text{OH} \right)}_{\text{3}}}\text{+3}{{\text{H}}^{+}}$,操作③在加热的条件下通入$\rm HCl$,使得水解平衡逆向移动,故$\rm HCl$的作用是抑制$\rm Ce^{3+}$水解防止生成沉淀;在氩气氛围中加热的目的是防止加热过程中$\text{CeC}{{\text{l}}_{3}}$被空气中氧气氧化;
对$\text{CeC}{{\text{l}}_{3}}$样品纯度进行测定的方法:准确称量样品$\rm 12.5\;\rm g$,配成$\rm 200\;\rm mL$溶液,取$\rm 50.00\;\rm mL$上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵$\left[ {{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}{{\text{S}}_{2}}{{\text{O}}_{8}} \right.$]溶液使$\mathrm{Ce}^{3+}$被氧化为$\text{C}{{\text{e}}^{4+}}$,然后用萃取剂萃取$\text{C}{{\text{e}}^{4+}}$,再用$1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$的$\text{FeS}{{\text{O}}_{4}}$标准也滴定至终点,重复$\rm 2\sim3$次,平均消耗$\rm 10.00\;\rm mL$标准液。计算$\text{CeC}{{\text{l}}_{3}}$样品的纯度为 $\rm \%$。
$\\rm 78.88$
"]]$\text{C}{{\text{e}}^{4+}}$和亚铁离子发生氧化还原反应生成$\mathrm{Ce}^{3+}$和铁离子,结合$\rm Ce$元素守恒和电子守恒存在,$\text{CeC}{{\text{l}}_{3}}\sim \text{C}{{\text{e}}^{4+}}\sim \text{FeS}{{\text{O}}_{4}}$,则$\text{CeC}{{\text{l}}_{3}}$样品的纯度为$\dfrac{1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\times 0.010\text{ L}\times 246.5\text{ g}/\text{mol}\times \dfrac{200}{50}}{12.5\text{ g}}\times {100 } \%=\rm 78.88\%$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
